FDA更新!2023有源医疗器械创新论坛分享生物相容性指南,明确不需要进行测试的器械和材料
2023-09-25
教科书里,生物相容性是指生物医用材料与人体之间相互作用产生的各种生物、物理、化学反应的性质,包括组织相容性、血液相容性、力学相容性以及免疫相容性等方面,是生物材料研究中贯穿始终的主题。
2023.09.08,FDA更新生物相容性指南,即,Use of International Standard ISO 10993-1, “Biological evaluation of medical devices – Part 1: Evaluation and testing within a risk management process,取代2020年的最终指南。
【更新背景】
本指南此次修订,增加了2020年指南草案“Select Updates for Biocompatibility of Certain Devices in Contact with Intact Skin”中描述的建议。 最终指南反映了FDA目前对某些与完整皮肤接触的医疗器械上市前提交中应提供的生物相容性信息类型的看法(见指南附录G)。
【更新内容概述】
更新内容主要是增加了附录G Biocompatibility of Certain Devices in Contact with Intact Skin,描述了以下内容:
• 使用与完整皮肤接触的普通材料制成的某些医疗器械的建议。附录G列出的材料范围包括:
1)聚合物,如塑料或硅胶,和
2)织物,如棉或人造丝。
• 申请人可以用来决定何时适用附录G中的策略的方法。
• FDA建议在上市前提交的材料中包括什么样的信息和标签?
• 生产商如何使用质量管理体系和上市后策略,包括采购和生产过程控制以及客户投诉审核,来识别生物相容性问题。
【哪些类型的器械可以豁免生物相容性测试?】
满足以下所有要求的器械可豁免生物相容性测试:
1)仅接触完整皮肤表面的医疗器械或组件;
2)接触持续时间:有限(≤24小时)、延长(> 24小时至30天)和长期(> 30天),包括重复使用设备,以及
3)由下节概述的材料组成。
【以上器械哪些材料可以豁免生物相容性测试?】
FDA已经确定了只接触完整的皮肤表面的最终成品器械中包含的特定材料可以豁免生物相容性测试。
这些材料可以包括其他加工化学品和添加剂(例如,增塑剂、填料、颜色添加剂、
清洁剂、脱模剂)。除了色素添加剂,这些化学物质不需要在接触皮肤的器械的上市前递交文档中披露接触信息。
由以下材料制成,并且可以由单一材料制成或者多种材料,例如聚合物混合物制成的以上器械可以豁免生物相容性测试:
合成聚合物:
• 丙烯腈丁二烯苯乙烯塑料(ABS);
Acrylonitrile-butadiene-styrene plastic (ABS);
• 醋酸纤维素 Cellulose Acetate;
• 固化环氧胶粘剂(用于连接医疗器械组件) Cured epoxy adhesives (used to attach medical device components to each other);
• 含氟聚合物,包括聚四氟乙烯(PTFE)、膨胀聚四氟乙烯(ePTFE)、聚偏氟乙烯(PVDF)和全氟(乙烯-丙烯)塑料(FEP)
Fluoropolymers including polytetrafluoroethylene (PTFE), expanded polytetrafluoroethylene (ePTFE), poly(vinylidene fluoride) (PVDF), and perfluoro(ethylene-propylene) plastic (FEP);
• 丁腈橡胶 Nitrile Butadiene Rubber (NBR);
• 聚对二甲苯 Parylene;
• 聚酰胺(PA),如尼龙和魔术贴Polyamides (PA), such as nylon and Velcro®;
• 聚对苯二甲酸丁二醇酯 Poly(butylene terephthalate) (PBT);
• 聚碳酸酯 Polycarbonate (PC);
• 氯丁,如氯丁橡胶
Polychloroprene, such as neoprene;
• 聚醚醚酮
Polyetheretherketone (PEEK)
• 聚醚酮酮
Polyetherketoneketone (PEKK);
• 聚醚嵌段酰胺
Polyether block amide (PEBA), such as PEBAX®;
• 聚醚酰亚胺 Polyether imide (PEI);
• 聚乙烯,包括低密度聚乙烯(LDPE)和高密度聚乙烯(HDPE)
Polyethylenes, including low-density polyethylene (LDPE) and high-density polyethylene (HDPE);
• 聚对苯二甲酸乙酯(PET),如尼龙搭扣Poly(ethylene terephthalate) (PET), such as Velcro®;
• 聚甲基丙烯酸甲酯
Poly(methyl methacrylate) (PMMA);
• 聚甲醛
Polyoxymethylene (POM);
• 聚苯砜
Poly(phenylene sulfone) (PPSU);
• 聚丙烯
Polypropylene (PP);
• 聚苯乙烯(PS),包括高冲击聚苯乙烯(HIPS) Polystyrene (PS), including high impact polystyrene (HIPS);
• 聚氨酯(PUR),如莱卡
Polyurethanes (PUR), such as Lycra®;
• 聚乙烯醇
Polyvinyl alcohol (PVA); or
• 硅橡胶
Silicone
天然纤维:
• 棉织物
Cotton fabrics;
• 人造丝织物,或
Rayon fabrics; or
• 丝织物
Silk fabrics
更多医疗器械法规以及监管条例解读,请关注2023有源医疗器械创新论坛Medtec创新展。创新展设立 “中外医疗器械政策法规” 、“中外医疗器械质量”等论坛,保证企业创新产品的合规上市,助力医疗器械全生命周期各环节质量安全监管。点击立即报名参观2023有源医疗器械创新论坛Medtec创新展。
【510(k)递交文档中应新增哪些信息以支持豁免测试?】
FDA建议在上市前提交中包含符合以上要求的以上器械的以下信息:
• 用于制造器械的所有材料(包括着色剂)或仅直接或间接接触皮肤的组件的材料的清单;
• 一份声明,确认器械材料属于上述材料(即,Section B中列出的材料),并有一份合法销售的医疗器械的安全使用记录(例如,通过医疗设备报告(MDR)分析、文献搜索);
•2023有源医疗器械创新论坛Medtec创新展分享, 确认不属于Section C中列出的排除情形(即,下图G.1中排除的器械)的声明;
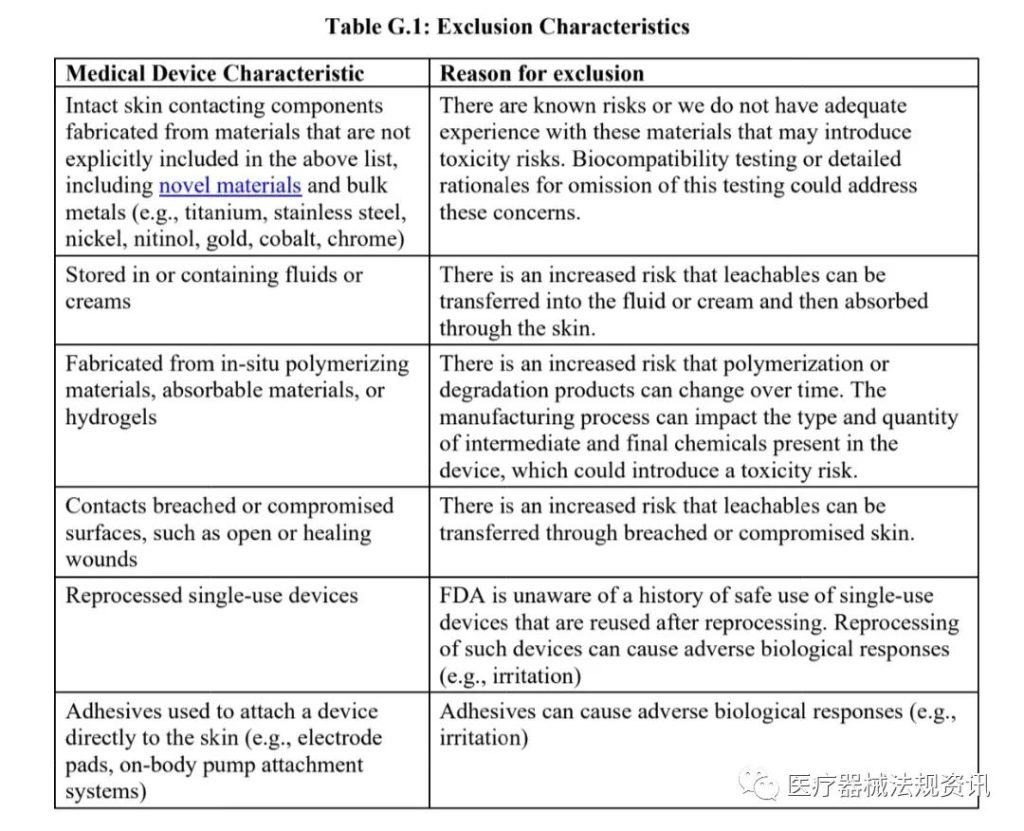
文章来源:













