医疗器械制造展关注|心脏节律管理设备等有源医疗器械如何进行临床评价?
2022-05-24
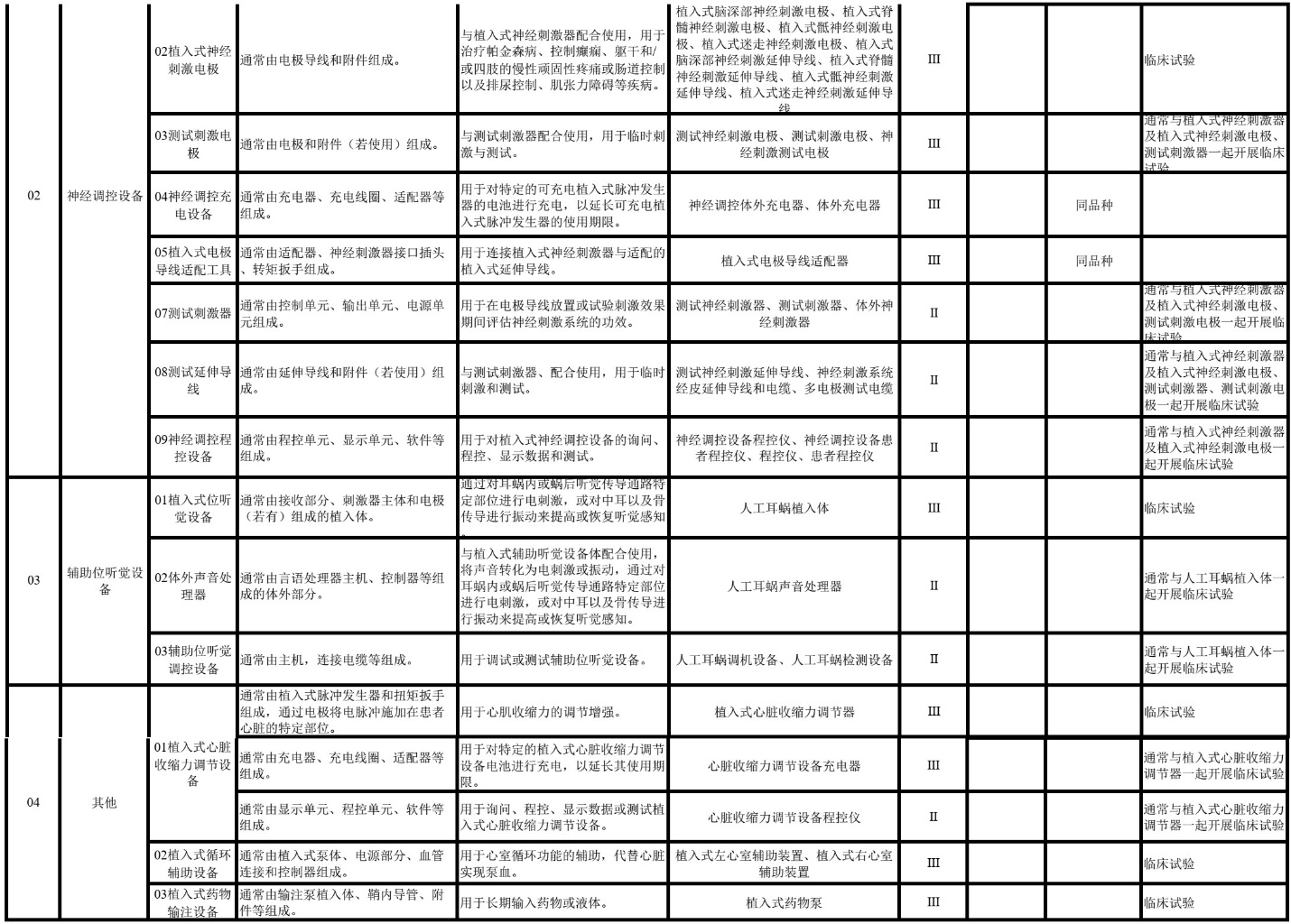
近日,医疗器械制造展Medtec中国了解到为进一步指导注册申请人确定具体产品的临床评价路径,器审中心按照《医疗器械监督管理条例》的有关规定,根据《决策是否开展医疗器械临床试验技术指导原则》等规范要求,基于目前的审评经验以及《医疗器械分类目录》中的子目录11“医疗器械消毒灭菌器械”、12“有源植入器械”、13 “无源植入器械”、14 “注输、护理和防护器械”、15“患者承载器械”、17“口腔科器械”、22“临床检验器械”的产品描述以及预期用途和品名举例,提出具体产品临床评价的推荐路径。


2021年6月,新版《医疗器械监督管理条例》(国务院第739号令)施行,明确规定“进行医疗器械临床评价,可以根据产品设计特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械安全、有效”。
2021年9月,国家药监局发布医疗器械临床评价配套规范性文件,其中《决策是否开展医疗器械临床试验技术指导原则》(2021年第73号,以下简称“《决策导则》”)从“高风险医疗器械”、“新型医疗器械”、“已有证据的充分性”三个方面指导申请人决策申报产品是否需要开展临床试验。
医疗器械制造展Medtec中国今年升级打造了16大特色展区,包括有源医疗装备核心部件,研发设计及软件服务,医用橡胶塑料,粘合产品和医用配件,医疗制造自动化,超精密激光加工,机床及增材制造,医用3D打印骨科加工专区等,目前已经吸引了3M中国、Acme Monaco、安姆科中国,迈得,科莱恩、通快,相干,埃万特、韬睿和安平医疗器械科技(厦门)等行业知名品牌确认加盟。点击立刻获取参会机会
编写了《医疗器械分类目录子目录11“医疗器械消毒灭菌器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录12“有源医疗器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录13“无源医疗器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“14 注输、护理和防护器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“15 患者承载器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“17 口腔科器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“22 临床检验器械”相关产品临床评价推荐路径》,给出具体产品临床评价路径选择的推荐意见。对于产品数量较少,近几年无相关产品申报的,暂未在该文件中体现。
文件中标注“临床试验”的产品,基于目前认知,通常为《决策导则》中的“高风险医疗器械”,除该指导原则第三部分第(一)款中可考虑免于开展临床试验的情形,原则上需要开展临床试验。
文件中标注“同品种”的产品,如申报产品与同品种医疗器械相比,适用范围、技术特征和/或生物学特性等方面具有显著差异,属于《决策导则》中提出的“新型医疗器械”,除《决策导则》第三部分第(二)款中可考虑免于开展临床试验的情形,需提交申报产品的临床试验资料。
文件中标注“同品种”的产品,如不属于《决策导则》中提出的“新型医疗器械”,申请人可按照《医疗器械临床评价技术指导原则》《医疗器械临床评价等同性论证技术指导原则》《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号)的相关要求,根据申报产品特征、临床风险、已有临床数据等情形,选取合适的同品种医疗器械,通过对同品种医疗器械临床数据进行分析评价,证明医疗器械的安全性、有效性。此种情形下,如通过非临床研究未能证明差异性部分的安全有效性,即《决策导则》中提出的“已有证据不能证明产品符合医疗器械安全和性能基本原则”。例如,常规功能的胰岛素泵可采用同品种比对途径提交临床评价资料,但具有闭环调节功能或采用新型闭环调节软件算法的胰岛素泵属于“新型医疗器械”,需提交申报产品的临床试验。
更多关于中国医疗器械法规更新与应对等议题将会出现在医疗器械制造展Medtec中国,包括《医疗器械监督管理条例》解读以及医疗器械质量管理信息化等多项议题,届时将有行业大咖开讲,希望能对各位医械制造商们有所启发。
来源:CMDE












