2017 年医疗器械经营企业飞行检查主要问题分析
2018-05-22
自国家食品药品监督管理总局(以下简称总局)组织开展飞行检查以来,检查中发现的问题和情况被业内企业普遍关注,更有部分企业将检查公示文件作为内审自查的比照标准。当前医药监管系统正在遵循“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责”来开展食药器械全程监管,全行业都需要不断加强学习和交流,深刻领会各项政策规定和文件精神,不断完善和提高自身质量管理体系的能力和水平。有鉴于此,将2017 年度经营企业飞行检查的结果进行了分析和梳理,相关情况如下。
1.基本情况
1.1 检查企业数
2017 年11 月19 日~11 月24 日,总局组织45 名医疗器械监管业务骨干,对15 个省(市)的30 家医疗器械批发、进口医疗器械境内代理商等经营企业开展了飞行检查[1]。
1.2 检查结果
通过检查发现,4 家企业质量管理体系存在严重问题,总局建议各省(市)食品药品监督管理局责令其立即停止经营进行整改,24 家企业存在不符合《医疗器械经营质量管理规范》[2](以下简称《规范》)和《医疗器械经营监督管理办法》[3] 的问题,总局建议各省(市)食品药品监督管理局责令其限期整改,2 家企业检查前已停止经营。
1.3 现场检查发现的缺陷项目
1.3.1 缺陷项目数量情况
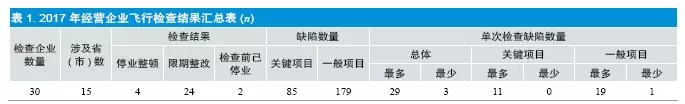
经对现场检查报告的审查,28 家正常营业的企业合计发现缺陷264 项,其中关键项目不符合要求的85 项,一般项目不符合要求的179项。单次检查发现不符合项最多者29项,最少者3 项;关键项最多者11 项,最少者0 项;一般缺陷最多者19 项,最少者1 项。相关情况见表1。
1.3.2 缺陷项分布情况
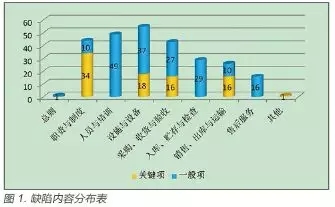
除附则外,《规范》的其余8 章节中均发现存在缺陷项。通过对现场检查存在的缺陷项进行统计分析后发现,缺陷相对集中在设施与设备及人员与培训等2 个章节,其次为职责与制度、采购收货与验收等2 个章节,入库贮存与检查、销售出库与运输、售后服务与总则等章节缺陷项较少。缺陷数目情况详见图1。
1.3.3 缺陷项目频次分布
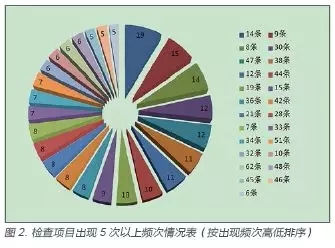
上述现场检查发现的264 条缺陷项,共涉及《规范》内容49 项,出现3 次以上(含3 次)的缺陷内容共有30 项,合计240 条,占检查发现总缺陷项目数的90.9%。其中出现频次最高的是《规范》中在“人员与培训”章节的第14 项,共出现19 次,占本次正常经营的28 家企业比例接近70%,该项原文是“企业应当对质量负责人及各岗位人员进行与其职责和工作内容相关的岗前培训和继续培训,建立培训记录,并经考核合格后方可上岗。培训内容应当包括相关法律法规、医疗器械专业知识及技能、质量管理制度、职责及岗位操作规程等。”检查过程中发现很多企业虽然建立了岗前培训和继续培训等相关制度,但年度培训计划和培训内容过于笼统,相关培训记录、考核及评估记录缺失等情况较为突出,无法提供相应证明。这点直接导致检查员现场与关键岗位员工谈话,发现后者对医疗器械相关法规不熟悉,未掌握医疗器械产品的专业知识的情况较为突出。排在第二位和第三位的分别为《规范》中在“职责与制度”章节的第9 项和第8 项,出现频次超过了本次检查企业数量的一半,主要涉及企业未按照《规范》要求建立全面的质量管理制度(第8项)以及企业的质量管理记录制度履行不到位,进货查验记录及销售记录未按照《规范》中的相关要求严格执行(第9项)。各缺陷项出现频次情况见图2。
2.发现主要问题
2.1 质量管理制度不健全,监管落实不到位
检查中发现部分企业顶层设计不健全,质量管理制度内容缺失甚至流于形式,表现在有的企业提供的《质量管理制度》没有根据现行的相关法规和企业经营的实际情况行进编写,不能覆盖医疗器械经营全过程,无可操作性;未对其经营的产品进行风险识别并采取相应的质量管理措施;体系文件中缺少《规范》中要求建立的相应制度;质量管理制度未经过审核审批等情况。部分企业质量负责人未能切实履行监管责任,表现在有的企业不能提供质量负责人任命文件和职责权限文件;不能提供质量负责人在质量管理工作中履行职责的相关记录;检查期间质量负责人不在岗等情况。
2.2 企业员工缺少培训,素质亟待提高
部分医疗器械经营企业不重视员工的法律法规及专业知识的培训,从业人员法律意识比较淡薄,表现在有的企业质量管理、经营等关键岗位人员学历不符合《规范》中的相关资格要求;未能提供培训、考核、上岗评估及继续教育等记录;收集法律法规不全,质量负责人不熟悉医疗器械监督管理的法律法规知识等情况。
2.3 设施装备与经营范围和规模不相适应
未配备与经营范围和规模相适应的设施装备,表现在有的企业库房中器械与地面之间无有效隔离的设备;无防虫、防鼠设施;库房未严格按照分区管理要求摆放产品;各区标识不清晰;经营第三类医疗器械的企业,未配备符合医疗器械经营质量管理要求的计算机信息管理系统;虽配备了计算机管理系统,但功能缺失或未正常使用等情况。
2.4 贯穿经营全生命周期的各个环节缺乏有效管理
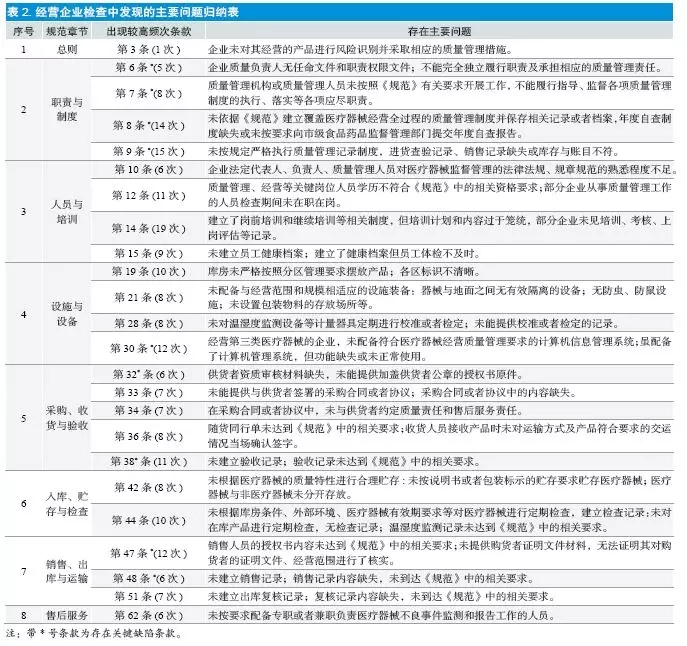
“重经营轻管理”的现象普遍存在,对《规范》只做到浅层执行,不能够做到规范、有条理、可追溯、持续性的高质量管理。表现在有的企业在购进验收储存销售各环节中存在记录填写不规范,项目不完整的问题;制定了质量管理制度,但未严格按照制度的要求开展质量管理活动,形成相应记录;未按要求配备专职或者兼职负责医疗器械不良事件监测和报告工作的人员等情况。主要问题归纳情况详见表2。
3.对策与建议
3.1 加强法规宣贯
针对《规范》实施以来企业普遍存在的内部培训不到位,人员素质较低,质量管理意识不强等重点问题,建议地方省局及企业所在地设区市局能够加大法规培训力度,提升企业人员素质,进一步加强对企业法人,质量管理人员以及关键技术岗位人员的重点培训,同时进一步加大对器械经营企业实施《规范》的帮促指导力度,有效推动《规范》的贯彻实施。
3.2 监督检查常态化
建议一方面公告检查结论,督促企业整改。总局应要求企业所在省局对存在违法经营行为的企业进行严厉查处,对存在不符合《规范》有关要求等问题的企业责令限期整改,并及时将查处和整改后复查情况上报,做到检查结果件件有落实。一方面将飞行检查作为一种常规手段纳入日常管理。完善飞行检查相关工作程序,以检查中发现的问题为导向,缜密安排,持续发力,将飞行检查常态化、制度化,对存在违法违规行为的经营企业形成强有力的震慑,促使企业不断提升自身的质量管理能力,推动医疗器械流通领域健康发展。
3.3 加强检查员队伍管理
党中央、国务院高度重视食品药品检查员队伍建设,在《“健康中国2030”规划纲要》《国民经济和社会发展“十三五”规划纲要》《国务院关于改革药品医疗器械审评审批制度的意见》中都强调建立职业化的检查员队伍,实现食品药品检查员队伍的职业化和专业化,这就对检查员的能力和素质提出了更高要求,国内专家学者也做出了相应的研究[4-6]。2016 年12 月29 日,国家食品药品监督管理总局在京举行首次新聘任国家级药品检查员颁证及宣誓仪式。毕井泉局长出席并讲话,对如何做一名合格的检查员提出了六方面要求,他指出检查员要忠于党和人民,忠于法律,忠于食品药品监管事业;要具备判断是非的能力、发现问题的能力、稽查办案的能力,国家级检查员更要具备研究检查方法的能力和文字表达的能力;要熟悉食品科学、药品科学的专业知识,熟悉法律、计算机应用、财务分析的基本知识;要培养科学务实、严谨细致、雷厉风行的作风;要树立坚持原则、刚正不阿、铁面无私的正气;要守住不徇私枉法、不收受贿赂、不泄露秘密的底线[7]。检查员队伍专职化的优点是便于管理和能系统地接受培训,不断提高检查能力。鉴于目前承担经营企业监督检查任务的多为地方省局及市局检查员,为统一检查员的培训与考核,建议以总局审核查验中心负责培训的组织与开展,制定科学合理的战略目标,建立符合GSP检查要求的培训课程体系,形成一支敢打硬仗、能够持续改进、保持自身活力的检查员队伍。
4.小结
医疗器械GSP监管体系的完善对我国医疗器械经营环节质量的持续提高和医药产业的健康发展意义重大。通过分析汇总检查中发现的问题,便于利用有限的监管力量,做到有的放矢,继续保持高压态势,加强监督检查,消除医疗器械质量安全隐患,保证公众用械安全。
来源:中国医疗器械信息杂志












