医疗器械同品种比对要点解析
2021-04-27
重点问题:
—同品种临床评价是临床评价,还是临床前研究的对比?
—除了转移生产、技术转让、基于上一代产品的改进,大多数情形下申报产品与同品种产品从原材料、生产过程到设计均存在不同程度的差异,如何认为申报产品与同品种产品等同?
—同品种产品已经过上市前评价准予上市,为何还要求申报产品的申请人收集同品种产品的临床数据并进行分析评价?
同品种临床评价的4个关键步骤
为了回答这些问题我们一起来回顾一下同品种评价的4个关键步骤:
1、同品种产品的选择
申报产品与同品种产品进行对比
—若完全相同→3、同品种产品临床数据
—若存在差异→4、差异性部分的安全有效性证据
那么在步骤2,3,4中可能会存在以下问题:
2、申报产品与同品种产品进行对比
—我要对比什么项目?
—对比多少算充分?
3、同品种产品临床数据
—提交的目的是什么?
—提交多少算充分?
4、差异性部分的安全有效性证据
—非临床证据就够了?还是一定要提交临床证据?
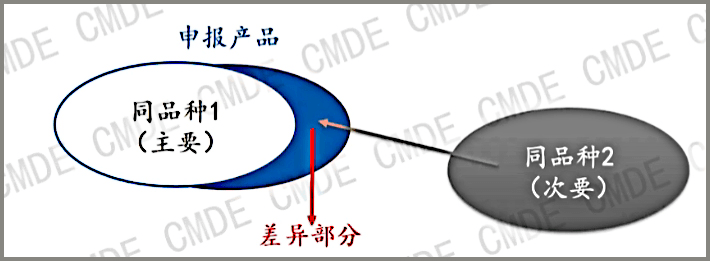
同品种产品的选择
选择目的:使用同品种产品的临床数据,开展申报产品的临床评价。选择目的:使用同品种产品的临床数据,开展申报产品的临床评价。
如何选择:与申报产品更为相似的产品 (对申请者、监管方都是最小负担)
如何看待多个同品种产品:共同证明申报产品的安全有效性 (证据集合)
 图片来源:CMDE
图片来源:CMDE
如图所示,当申报产品和同品种产品存在差异的时候,我们可能会引入第二个同品种产品即“同品种2”作为差异性的证据,这个时候我们需要关注的是,不同的设计特征适用范围在申报产品中组合时不应相互影响。
申报产品与同品种产品对比项目
参照法规:
医疗器械临床评价技术指导原则(2015年总局令第14号)
—技术特征
1.基本原理
2.结构组成
3.生产工艺
4.制造材料
5.性能要求
6.软件核心功能
7.安全性评价
8.符合的国家/行业标准
—适用范围及禁忌症
9.适用范围:
(1)适用人群
(2)适用部位
(3)与人体接触方式
(4)适应症
10.禁忌症
—产品说明书临床使用信息
11.使用方法
12.防范措施和警告
13.交付状态、灭菌/消毒
14.包装
15.标签
16.产品说明书
对比数据从哪里来?
—数据来源
公开发表的文献、数据、信息
试验室测试
计算机模拟研究
动物实验
前代产品信息
授权使用
—开展同品种临床评价的,如使用了同品种产品 非公开数据(如生产工艺、临床数据等),申请人应提交 使用授权书,以保证数据来源的合法性。
—使用 公开发表的数据,如公开发表的文献、数据、信息等, 不需取得授权。
同品种产品的临床数据
—同品种临床评价实质
使用同品种产品的临床数据开展申报产品的临床评价 (借用数据、实现数据外推来完成申报产品的临床评价)
—数据来源
临床试验数据、临床经验数据、临床文献数据
—同品种临床数据的作用
a.确认同品种产品的安全有效性在现有认知下,是否已得到临床公认,风险受益是否在可接受范围内;
d.基于同品种产品进行设计变更的依据;
e为部分非临床研究(如合架试验)测试结果的评价提供临床数据等。
差异性部分的安全有效性证据
当申报产品与同品种产品存在差异时,需提交 充分的科学证据证明二者具有相 同的安全有效性,从而论证其等同性。
1.增加具有可比性的同品种产品,提供临床证据
2.非临床研究(性能研究、台架试验、动物试验)
3.申报产品的临床证据
文章来源:医疗器械创新网












