法规政策
-
2021.10.28
医疗器械注册自检管理规定解读
国家药品监督管理局组织制定的《关于医疗器械注册自检管理规定》(国家药品监督管理局公告第126号,自印发之日起施行,以下简称《规定》),已于2021年10月21日印发。现就《规定》的制定背景、主要内容和重点问题说明如下……
阅读更多 -
2021.09.30
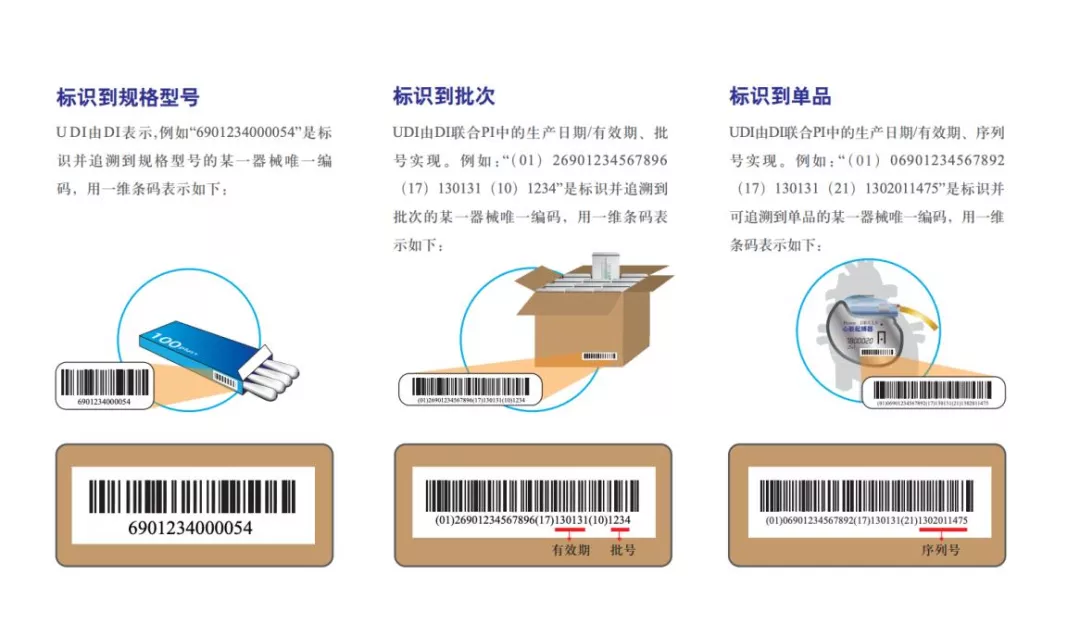
新政策!第三类医疗器械全部纳入UDI实施范围,这些事值得注意
9月17日,国家药监局、国家卫生健康委、国家医保局联合发布《关于做好第二批实施医疗器械唯一标识工作的公告》(以下简称《公告》)。《公告》明确,在第一批实施医疗器械唯一标识的九大类69个品种基础上……
阅读更多 -
2021.09.28
《医疗器械注册与备案管理办法》最全解读,这些变化你一定要知道!
8月31日,国家市场监督管理总局审议通过了《医疗器械注册与备案管理办法》和《体外诊断试剂注册与备案管理办法》(以下简称两个《办法》),自2021年10月1日起施行……

阅读更多 -
2021.09.15
新修订的《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》发布,10月1日起施行
日前,国家市场监督管理总局2021年第11次局务会议审议通过《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》(以下简称两个《办法》),自2021年10月1日起施行……
阅读更多 -
2021.09.02
市场监管总局发布《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》自2021年10月1日起施行
日前,国家市场监督管理总局2021年第11次局务会议审议通过《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》(以下简称两个《办法》),自2021年10月1日起施行……
阅读更多 -
2021.08.11
建立并完善增材制造医疗器械监管科学体系
增材制造(又称3D打印)技术是20世纪90年代发展起来的先进制造技术,它以三维数字化模型为基础,将材料自动化地累加起来成为实体零件,能够实现多种材料、复杂结构、单件小批量产品的快速制造……
阅读更多 -
2021.08.03
国家局:所有三类医疗器械将实施UDI
近日,国家药监局发布通知,拟将所有第三类医疗器械(含体外诊断试剂)纳入实施唯一标识范围。支持和鼓励其他医疗器械品种实施唯一标识……
阅读更多 -
2021.07.21
我国加速推进AI医疗器械标准化
今年是新修订《医疗器械监督管理条例》施行的第一年,企业主体责任更加突出,产品的验证与确认活动趋于多元化,业界对标准规范的需求更加强烈……

阅读更多 -
2021.06.30
创新医疗器械特别审查程序涉及的专利相关问题
自2014年创新医疗器械“绿色通道”开启以来,截至2020年12月底,已经有1471个产品申请进入创新通道,292个产品作为创新医疗器械被纳入该通道,约占全部申请项目的20%左右……
阅读更多 -
2021.06.28
从FDA检查作业指导书的方法理解法规证据链
对于怎样才是一份良好的作业指导书,没有一个标准答案, 在FDA检查中 通常制造商让研发和工艺工程师解释作业指导书和设计文件,工艺验证的关系,但是这并不全部满足FDA检查官的期望……
阅读更多












