医疗设备展聚焦人因工程与眼科: 一种新型预填充注射器概念的评价眼科应用
2022-08-23
玻璃体内注射(IVI)是全世界最常见的眼内手术,也是视网膜护理的基石(1,2)。2016年,仅在美国就实施了约600万次静脉注射(3)。目前有许多药物通过静脉注射治疗糖尿病性黄斑水肿(DME)、糖尿病性视网膜病变(DR)、新生血管性年龄相关性黄斑变性(AMD)、黄斑变性等疾病。
视网膜静脉阻塞(RVO)、葡萄膜炎和近视脉络膜新生血管(mCNV)后的水肿,以及更多的治疗方法正在研究中(4)。其中最重要的药物是血管内皮生长因子(VEGF)抑制剂,其功能是减少眼部血管生成和相关的血管渗漏(5)。在这项研究进行时,有三个FDA批准的VEGF抑制剂可用于IVI:PEGAPANTIB(MuuGEN;EyeTeCe,雪松KNOLLS,NJ),AFLLIPCEPT(Eylea;ReGeon制药公司,塔里敦,NY),和兰比珠单抗(LuxTeS;GeNeNeTeCe/RoCh,南圣弗朗西斯科,CA)。虽然不是FDA批准的IVI,贝伐单抗(Avastin;GeNeGeTea/RoCh,南圣弗朗西斯科,CA)也常用于视网膜手术(6)。研究时这些产品的可用包装配置见表一。
血管内皮生长因子
IVI通常由训练有素的视网膜专家(RS)进行,因为它需要无菌操作和极小剂量的精确输送(例如。, 0.05毫升)注入眼睛的精细结构。虽然该程序通常是安全的,但并不恰当这种技术会导致严重的副作用,如眼内炎、眼内炎症、视网膜脱离、眼压升高和眼出血(7)。其中一些并发症与药物准备有关(8-12),尤其是在使用常规皮下注射器时,手术过程中使用的硅胶润滑注射器(13-25)将硅油(SO)滴引入眼睛引起了特别关注。这些问题刺激了专为IVI设计的递送装置的发展,例如最近批准的雷尼珠单抗预充式注射器(PFS)(26)。使用PFSs输送IVIs有可能缩短注射时间,降低污染、眼内炎、眼内气泡等的风险,并提高给药精度(8,27–34)。
迄今为止,市面上销售的IVI药物都是装在玻璃主容器(小瓶或PFS)中的。由于潜在的玻璃缺陷和对SO润滑剂的需求(35),目前正在开发新型聚合物PFS装置。FDA建议制造商在开发新医疗设备期间进行人为因素测试,以确保其对预期用户、用途和使用环境安全有效。该过程通常从形成性测试开始,旨在告知设备用户界面的设计,减少或消除潜在的使用错误,确定培训和标签要求,并帮助定义验证(总结性)测试的结构(36)。我们展示形成性人为因素研究的结果,以支持开发一个可用的、无硅的IVI给药平台。除了注射给药,医疗设备展Medtec China技术论坛F:第六届医疗器械设计论坛中将详细解说家用/康复医疗设备设计中的人因工程。
PLAJEX是一种非常自由的预填充注射器系统,其聚合物桶由环烯烃聚合物(COP)和涂有i涂层技术的丁基橡胶柱塞塞组成。i型涂层在塞式注射器接口处提供润滑性,而无需在注射器筒内使用硅胶。所研究的PLAJEX注射器可提供最大0.5 mL的可填充容量,符合人体工程学的扩展逆止器,用于连接ISO 80369-7标准注射设备的传统公鲁尔,与集成鲁尔锁环兼容的新型防篡改端盖设计,以及一个内部模制的剂量标记,以帮助设置剂量(图1)。除了这些特征外,还评估了六种外部打印的剂量标记设计(两种不同的线厚和三种不同的周向图案),以供用户选择(图2),将这些设计与目前市面上使用的IVI PFS进行比较。
注射器配有防篡改的针头盖,该针头盖采用了一种机制,通过该机制,提供容器封闭的橡胶塞被困在带有清晰模制观察窗的白色塑料外壳内。取下(拧下)端盖时,橡胶在端盖内释放;如果重新安装,它将“弹出”,向用户提供已卸下盖子并随后重新安装的反馈(图3)。开发了原型使用说明(IFU),以纳入所有设计元素
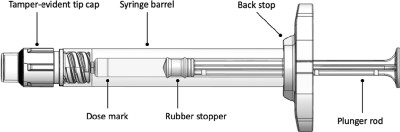
图1
概念设备设计和功能。
正在评估(图4)。研究IFU的使用步骤和措辞仿照FDA批准的雷尼珠单抗PFS IFU。
研究设计
该研究的三个主要目标是:1)根据执行IVIs的RSs评估拟议注射器设计的易用性和可接受性;2) evalu-为设计提供相应的IFU;3)识别设计中潜在的可用性问题。两个次要目标是:1)评估新的防篡改盖设计;2)比较几种外部打印的剂量标记设计。尽管在研究期间,参与者被要求对照现有产品评估概念设备,但这是为了建立基准,并确定设计改进的机会。本研究的目的不是比较不同给药装置的相对价值。
共有13名RSs完成了这项研究。所有参与者每周至少准备10次注射,并有注射阿利贝塞、雷尼珠单抗(包括小瓶和PFS)和贝伐单抗的经验。在13名参与者中,只有9人有过使用pegaptanib的经验。招聘是通过全国性的商业小组进行的,并采取了有目的的抽样方法 捕捉一系列人口特征,尽可能减少偏见。表二提供了参与者的人口统计数据及其最常使用的IVI产品。这项研究是根据《赫尔辛基宣言》和市场研究协会的《市场研究标准守则》的原则进行的;所有参与者均给予书面知情同意。
研究程序
这项研究是在美国的两个研究机构完成的,每个研究机构都配备了一套两室的套房,里面有一面单向镜子。两名研究主持人主持了可用性测试会议并记录了测试数据,所有访谈会议都从多个角度进行了视频记录,以捕捉使用错误、操作困难以及关键任务和安全关键任务的密切联系。研究开始时,每位参与者将具有代表性、解剖正确的注射眼的头部模型配置为正确的高度、侧面(左或右注射手,头部位于医生的左侧或右侧)和注射姿势(坐或站)。这确保了基于实际注射偏好/实践的适当位置。此外,研究室配备了检查手套,

图2
剂量标记设计方案。
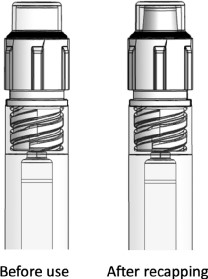
图3
防篡改端盖设计。
每个测试环节都是通过向参与者介绍测试环境、解释测试目的以及提出与人口统计相关的问题来启动的。然后向RSs展示了没有任何包装的概念设备、一个未打开的30号规格、1=2英寸注射针(BD,新泽西州富兰克林湖市)和一个印刷版的原型IFU。参与者是根据他们在实践中使用新设备的方式,指示他们尽可能多或少地使用IFU。概念装置预先填充0.2毫升安慰剂溶液,与雷尼珠单抗的粘度相匹配。准备好后,参与者使用安慰剂溶液和眼睛模型完成一种模拟IVI的制备和给药。在参加可用性测试之前,所有参与者都没有接受过正式培训或演示。在每项任务完成后和任务后访谈期间,主持人使用回顾性回顾技术对参与者进行了关于他们与设备互动的访谈。然后,参与者根据他们使用这些产品的经验,评估了该概念设备的易用性、舒适性、安全性和总体偏好,与阿利贝西普瓶、雷尼珠单抗PFS、雷尼珠单抗瓶和培加他尼瓶相比。贝伐单抗被排除在偏好评估之外,因为它未经FDA批准用于静脉注射。评分采用7分利克特量表(1=“完全不同意”,4=“中立”,7=“完全同意”)。接下来,RSs收到了第二个预先填充的概念注射器,其中包括外部打印的剂量标记替代品,并被要求提供关于偏好的主观反馈。最后,要求参与者就概念设备设计的特定方面(即防篡改盖、塑料结构、缺乏SO)提供主观反馈。在记录参与者的回答之前,本节首先对每个功能进行了简要描述,因为在模拟使用过程中,有些功能可能并不明显(例如,缺少SO)。
医疗设备展Medtec China中亮相的过滤器和静脉注射产品供应商,包括颇尔药液/疏水呼吸通路过滤器、疏水性混合纤维素膜、自排气精密过滤器、4TipTM 系列吸头滤芯、血液透析器封装系统、鲁尔接头、微流量调节器等。
基本和安全关键任务
对产品预期用途的评估确定了总共10个使用步骤,其中6个属于基本任务,4个属于安全关键任务,符合组合产品人为因素工程最佳实践。为了将设备成功地用于其预期目的,一项基本任务是必要的,但如果错过,将不会导致安全问题。另一方面,安全关键任务是用户可能会犯错误的任务,这些错误会对临床产生负面影响。然后,根据表III中提供的定义,评估每项任务是否成功,无问题、不完整/不正确(I)、已解决(R)、操作困难(OD)、近距离呼叫(CC)、研究伪影(SA)或未评估(NA)。表IV总结了基本和安全关键任务及其相应评估。
后果
注册的RSs每个都完成了10个使用步骤,总共提供了130个偏离IFU中提供的说明的使用错误机会。在这130个步骤中,110个成功,17个不完整或不正确,2个得到解决,1个是研究伪影的结果(表IV)。没有参与者多次犯相同的错误,也没有参与者在测试期间需要测试管理员的帮助。所有13名参与者成功完成了6项基本任务中的3项(通过扭动固定针头、通过拉动移除针头护罩,以及从注射部位移除注射器),至少10名参与者成功完成了4项安全关键任务中的每一项。在整个测试模拟过程中,总共发生了20次错误,其中12次是在基本任务期间,8次是在安全关键任务期间。绝大多数情况下,检查端盖是最重要的原型使用说明。常见的不完整或错误步骤,只有四名参与者成功完成。表V总结了所有使用错误,下一节将对每个错误进行解释。
使用步骤的总结和评估
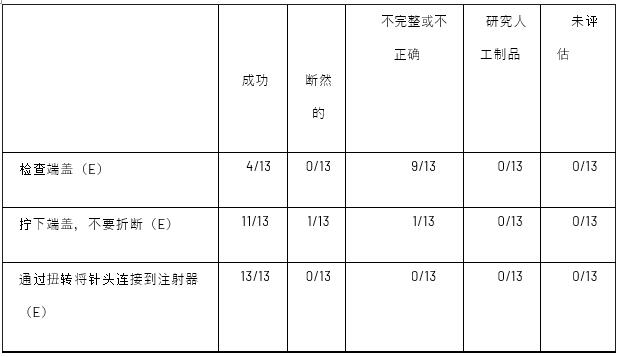
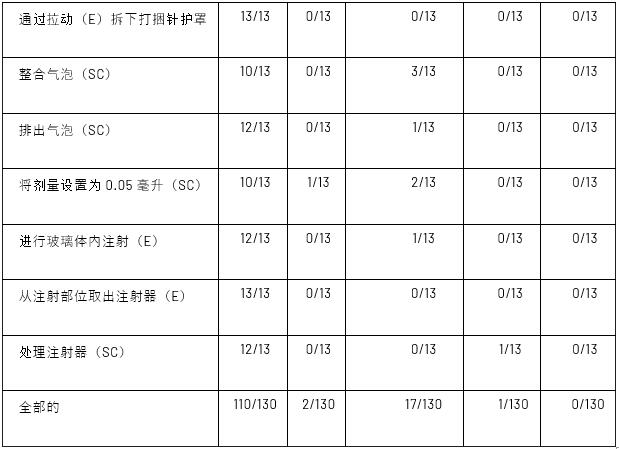
E=必要;SC=安全关键。
结论
总之,经验丰富的RSs发现,所研究的PFS设计对IVI是可用、可接受和安全的。研究中观察到的使用错误主要源于不熟悉的使用步骤或现有设备的转移行为,这两种行为都可以通过改进的说明和设计语言来解决。在研究之前,预计与剂量设置有关的小困难,参与者确定了一种潜在的外部剂量标记解决方案,以纳入总体设计。RSs更喜欢概念设备而不是小瓶提供的IVI产品,一半的RSs更喜欢概念设备而不是雷尼珠单抗PFS。概念装置的独特功能,包括无SO和耐破COP成分,大部分被参与者和可能的参与者认可对现有的IVI系统进行改进。总的来说,医疗设备展Medtec China了解到本研究的结果可用于指导设计改进和未来的形成性和终结性人为因素测试。
来源:小包服












