管理好新产品开发中的混乱
2018-08-29
梅奥诊所工程师介绍多年新产品开发总结出的深刻教训

开发新的医疗器械本身就存在一定风险。新器械设计不同于产品的增强或更新换代,重新设计只是将专利延期数年,没有显著的改善。而开发是要打造创新的产品,以有趣的新方式增加前所未有、也并非现有功能集合的新功能。
为管理其中的风险,企业采用了标准化实践,旨在使这个杂乱无章的流程变得井井有条。最常见的就是声名狼藉的瀑布开发模式。医疗器械制造商可能会在简单浏览 FDA 指导文件后误以为瀑布式方法是首选方法。但是除非产品简单易懂,否则这个流程会导致大量返工,最后完全失败;或使产品开发团队完全忽视方法,仅提交必要的报告。
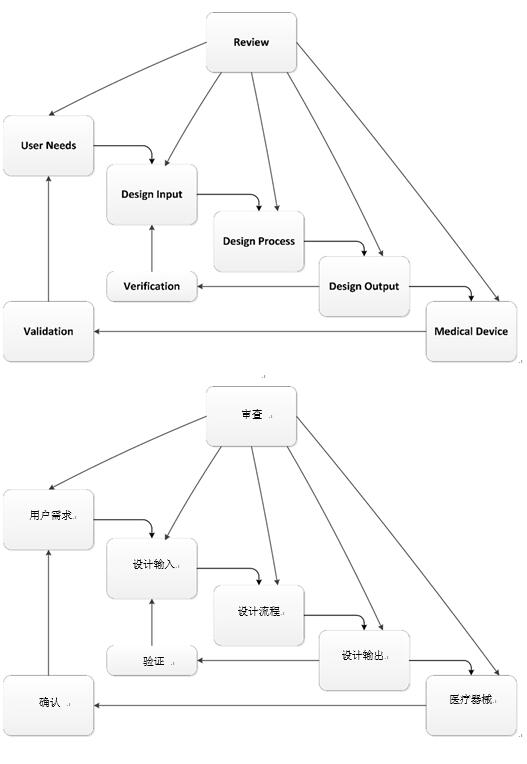
FDA 设计控制指导——瀑布式方法
开发新器械时,通常都没有具体的目标,您和您的客户不一定知晓最终产品会是什么。您可能知道要解决什么问题,但如果您真的在打造创新产品,解决方案一般都不那么显而易见。这就导致无法从头到尾地规划产品开发周期,使管理者和开发人员都感到挫败。我认为,如果要解决一个重大问题,就必须在开发和分析之间来回切换。
这并不是说要忽视流程。事实上,流程将更为重要,因为唯有流程才能为新产品开发带来些许秩序。大家一遍又一遍地探寻,“什么才是正确的流程?”遗憾的是,这个问题的答案通常都是“看情况吧。”
那么企业该怎么做呢?不管是基于 FDA 的规定还是理智判断,都应当采用明确的可重复流程。不过 FDA 并不要求使用特定的方法,尽管其设计控制指导文件中提供了瀑布式方法,但这一方法也有待商榷。
我认为渐进或迭代式开发流程是更为先进和可行的设计方法。这种流程能够逐步加深对问题和解决方案的了解。如果一开始不能确定解决方案,这一点将尤为重要。
渐进式开发流程非常适合开发递增式或转换性产品。不过,我们仍需要选择正确的流程。简单了解典型医疗器械流程图就能看出渐进式设计流程的便利性。
经过改进的 FDA 设计控制指导——渐进式方法
一个有效的设计方法必须立足于现实。根据目标调整开发人员的工作内容应作为设计方法的关键质量指标。通俗地说,如果确定的方法与开发人员的工作内容不相匹配,就不能满足21 CFR 820.30 设计控制的要求。
每个企业都各有不同,不能套用统一的开发流程。而我们将基于最低的交付成果,开发出一个适用的流程。我们已经确定了前端和后端流程,而在充满不确定的创意设计阶段,我们确定了触点,用以整理所有收集的信息。这些触点以审查为中心,主要审查新的要求、新的或更新的设计文件以及验证计划,还要审查安全风险评估。
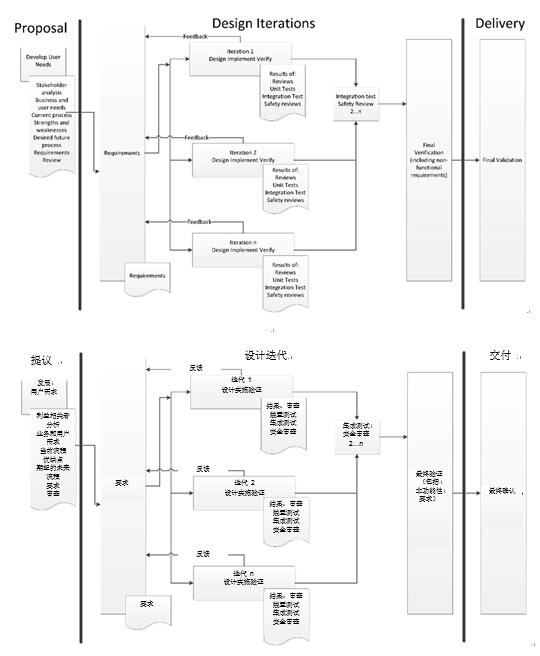
渐进或迭代式设计流程
如果能专注于关键设计交付成果的不断发展,在产品开发周期尾声,我们不仅能获得革命性的新产品,还能根据质量管理系统 FDA 21 CFR 820 获得完整的设计输入和输出文件。
渐进式设计并不是逃避流程或监管的借口。它需要更强的纪律性,以管理不确定性,并充分信任流程。要想通过迭代式设计流程成功领导团队,就必须了解规范的目的、清楚通过迭代流程达到目的的方式,并能应对不确定性。在看到稳定的流程进展前,管理者和利益相关者可能会有所疑虑。但当他们看到一两个失败的迭代可以在无需大幅更改时间安排的情况下快速改变计划并找到新方法时,就会逐渐支持这一方法。












