医疗器械博览会包装合规新思路:注射剂中微粒污染的法规要求与控制方法
2022-08-01
医药行业总是希望更安全、更可靠、零缺陷、无污染的药品包装,注射剂包装更是如此。一方面,由于有效性和生物利用度方面的优势,注射给药广为接受,预灌封注射器、卡式瓶、西林瓶等包装的市场需求不减;另一方面,随着生物药等大分子药物的崛起,药品配方变得越来越敏感,这也对药品包装提出了更高的要求。许多过滤器和静脉注射产品供应商纷纷亮相医疗器械博览会Medtec 中国展,他们将在现场带来包括颇尔药液/疏水呼吸通路过滤器、疏水性混合纤维素膜、自排气精密过滤器、4TipTM 系列吸头滤芯、血液透析器封装系统、鲁尔接头、微流量调节器等产品。对注射剂包装来说,硅油、纤维等微粒等污染隐患数十年来一直存在。一项调查数据显示,在2015-2020年间,微粒污染是注射类产品被召回的头号原因。
今天,我们就从法规要求和检测方法来聊一聊注射剂中的微粒污染控制,以及如何通过弹性体来降低污染风险:
1微粒的分类和来源,以及硅化工艺所带来的潜在风险
2从弹性体入手,全面减少微粒污染
3微粒检测方法和标准(附相关法规要求汇总)
微粒的分类和来源
微粒(Particulate matter)按照大小分包括可见异物(>100μm)和不溶性微粒(2-100μm))。从来源上看,可以分为内源性微粒、固有微粒和外源性微粒。
在对制药公司的调查中发现,在所有的污染类型中,最常见的是纤维素污染和聚酯纤维污染,而硅油污染也是较大的威胁2。
制剂产品中的微粒可能会来自哪些地方?
● 生产人员的服装和体表
● 设备的表面老化与机械磨损
● 物料中原辅料、包材带来的微粒
● 生产过程中灌装、过滤、冻干等工艺污染
● 生产环境中的墙面脱落、HVAC
虽然如此,我们却不可否认硅化工艺在医药初包装中起到重要作用。
其中最典型的例子是在预灌封注射器中,如果没有硅油进行润滑,纯玻璃和橡胶的包装系统则会因为阻力过大而无法工作。在灌装前将硅油喷洒在预灌装注射器内,能使活塞在给药期间沿玻璃针筒滑动。将硅油喷涂在瓶塞上,也有助于瓶塞在灌装和压盖工艺期间滑动到位。
但是,也有专家提醒,生物制品可能会对硅油产生反应,所以需要对新开发的配方进行稳定性研究,并通过微流成像(MFI)对蛋白质的硅油敏感性进行检测。这是为了防止在一些情况下,硅油与蛋白质发生相互作用并触发蛋白质聚集,使药物的安全性受到损害。
这便明确了目前医药包装行业针对硅油的研究方向:
● 既然硅油的使用在很多情况下无法避免,则需要通过改进硅油的选择和硅化工艺来最大限度降低硅油对生物制剂的影响。
● 对于某些关键的弹性体部件,如胶塞或者活塞来说,可以考虑使用更先进的替代工艺来杜绝硅油这一污染源。
从弹性体入手,减少微粒污染
硅油带来的污染固然是生物制剂微粒污染的重要来源。但从整体来看,弹性体引入的微粒污染,一部分来源于硅化、摩擦、吸附、穿刺等导致的外源性污染;一部分来源于硫化、冲切、清洗、包装等工艺带来的内源性污染,以及原辅料、包材中的物料污染。
因此,如果要全面解决弹性体引入的微粒污染问题,我们可以从以下几个方面进行思考:
针对外源性微粒
● 当需要进行硅化时,如何改进硅化工艺?如何选择合适的硅油粘度来减少微粒污染?
● 是否有更先进的工艺可以代替硅化?
● 如何改进橡胶本身的配方,减少穿刺落屑?
针对内源性和固有微粒
● 如何改进橡胶的硫化工艺?
● 如何改进整体生产环境、流程、清洗以及包装,从而降低污染风险?
若您想了解更多有关医疗器械灭菌的热点话题,不妨扫描下方二维码加入医疗器械博览会Medtec 中国展“技术论坛K:第五届医疗器械包装与灭菌论坛”,来自安姆科中国等企业的嘉宾将从材料、方案选择等多方面为与会人员讲解医疗器械灭菌与包装的重点及难点。议题覆盖医疗器械包装的选择和评估、闪蒸法最终医疗器械包装材料Dysan(r)介绍及应用分享等。点击快速预登记。
为了将微粒减少到极致,德特威勒开发了一种无需硅化的专利氟化聚合物涂膜。OmniFlex®️和NeoFlexTM是目前业内最先进的涂膜解决方案,可以满足对高灵敏度大分子药物的质量和性能的最高要求。
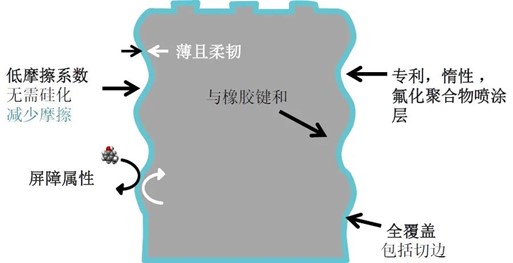
从弹性体入手的微粒解决方案包括:

微粒检测方法和标准
通过一系列的配方和工艺优化,我们已经可以最大限度降低微粒污染对于弹性体部件的影响。那么,如何验证弹性体部件是否符合注射剂异物或微粒相关法规要求?
医疗器械博览会Medtec 中国展分享以下几种方法:
可见异物测试方法
1. 灯检法(需要注意不同法规中照度要求的不同)
2. USP/EP/JP中照度要求为2000-3750lx,塑料容器更高,在JP中照度达到8000-10000lx;中国药典中照度相对低一些:无色透明溶液1000-1500 lx,塑料容器棕色透明2000-3000lx,混悬液、乳状液至4000 lx。
3. 其它半自动/自动化技术(光散射法)
不溶性微粒检查法
1. 光阻法——光阻法不适用于黏度过高和易析出结晶的制剂,也不适用于进入传感器时容易产生气泡的注射剂。
2. 显微计数法——当光阻法测定结果不符合规定或供试品不适于用光阻法测定时,应采用显微计数法进行测定,并以显微计数法的测定结果作为判定依据。
3. 其它方法如流体成像不溶性微粒法规要求(特殊制剂除外)
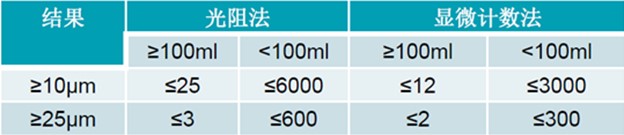
中国药典中对不溶性微粒的检测要求 ▲
小贴士:
注射剂异物/微粒相关法规要求汇总
可见异物:
● USP<790>注射剂中的可见异物
● USP<1790> 注射剂的可见异物检查
● EP 2.9.20 微粒污染物:可见异物
● Ch.P. <0904>可见异物检查法
● JP 6.06 注射液可见异物检查法
● JP 6.11 眼用溶液可见异物检查法
不溶性微粒/亚可见微粒:
● ICH Q4B Annex 3 微粒污染物:不溶性微粒
● USP<788>注射剂中不溶性微粒
● JP 6.07 注射液不溶性微粒检查
● EP2.9.19 微粒污染物:不溶性微粒
● Ch.P<0903>不溶性微粒检查法
● USP<787>治疗性蛋白注射液中的不溶性微粒
● USP<789>眼用溶液的微粒
● USP<1787>治疗性蛋白中的不溶性微粒检查法
● USP<1788>注射剂中不溶性微粒的测定方法
● JP 6.08 眼用溶液的不溶性微粒
来源:德特威勒医药包装












