心血管病最后的战场,心衰器械治疗的黄金十年
2022-01-10
心力衰竭由于预后差、治疗手段有限、患者死亡率高等特点,被称为心血管病的最后堡垒。近些年来,在攻克心衰的坎坷征途中出现了一些新技术和新器械。此文为我们介绍心衰治疗的未来景象。
1. 心血管最后的战场,器械治疗新百亿机遇
(1)心衰患者池构成与发病频率
老龄化与慢病高发,推动心衰患者池增长
心力衰竭(heartfailure,HF),简称心衰,心衰并不是一个独立的疾病,而是各种心脏疾病的严重表现或心脏疾病发展的终末阶段。由于我国人口结构变化–老龄化加剧,冠心病、高血压、糖尿病、肥胖等慢性病的发患病率呈上升趋势,医疗水平的提高使心脏疾病患者生存期延长,导致作为各类心血管病终末期的心衰患病率呈持续升高趋势,且死亡率和再住院率居高不下。
心衰患病率与发病率双高
全球患病人群近3000万:
2019年,全球心力衰竭患病人数达2970万,预计2030年将进一步增加到3870万,即2024年至2030年的复合年增长率为2.5%。发达国家的心衰患病率为1.5%~2.0%,≥70岁人群患病率≥10%[1]。
其中,美国心力衰竭的患病人数2019年达657.8万,预计在2024年728.4万,增长率2.1%。预计2024至2030年增长率2.0%,2030年将达到820.8万人。
全球老龄化推高心衰患病率:
20岁以上人群,随着年龄每增加10岁,心衰患病率约增加1倍[2]。美国男性20-39岁心衰患病率0.2%,40-59岁心衰患病率1.5%,60-79岁心衰患病率7.8%,80岁以上心衰患病率8.6%。心衰患者中,88%患者年龄超过65岁,49%年龄超过80岁[3]。从2017年至2030年,心衰患者的绝对数量预计将增长46%[4]。
中国患病率与发病率双高:
2003年的流行病学调查显示,我国35~74岁成人心衰患病率为0.9%[5],2021年患病人群约1370万人。在2019年新发患者214万,自2014年至今增速1.6%。
与国内其他心衰研究人群比较发现,目前中国心衰住院患者的平均年龄呈上升趋势,中国住院心衰患者的平均年龄为65岁。2019年心衰的患者人数迅速增至1,067.8万人,预计到2030年达1,614万人,增速3.6%。
China-HF研究[6]显示,住院心衰患者的病死率为4.1%。2019年,心力衰竭死亡人数达到约170.9万人,2030年估计达到193.4万人,由于死亡率的增长率略低于患病率,预计今后心力衰竭患者池将显著增长。
心衰病程特点:进展期震荡反复、终末期持续恶化
目前认为心衰是慢性、自发进展性疾病,早期心肌重构可以对心功能产生部分代偿,但随着心肌重构的加剧,心功能逐渐由代偿向失代偿转变,出现明显的症状和体征。
故根据心衰发生、发展过程,分为早期、进展期、终末期阶段。心衰患者的管理应以患者为中心,涉及住院前、住院中、出院后的多个环节,包括急性期的救治、慢性心衰治疗的启动和优化、合并症的诊治、有计划和针对性的长期随访、运动康复、生活方式干预、健康教育、患者自我管理等,对于改善患者的生活质量、延缓疾病的恶化、降低再住院率具有重要意义。各阶段的治疗重点各不相同:
①心衰早期:患者有发生心衰的高风险,此阶段强调早期预防相关风险因素;
②心衰进展期:重点在于治疗方案的综合优化、加强管理、延缓心衰进程,降低再住院率(预防结构性心脏病进展,包括瓣膜、心肌等),预防心脏源性猝死(ICD、WCD等),并在急性失代偿心衰发作时快速稳定血流动力学、增加心排血量、维持组织器官灌注(药物和心室辅助装置ventricular assist device, VAD)。
③心衰终末期:采取姑息治疗、心脏移植或长期VAD。
与常见的心血管系统原发病治疗不同,心衰各阶段的系统性治疗方法涉及多方面评估与治疗,从早期风险因素识别到疾病进展进程的控制,需要针对患者情况进行多种治疗选择、针对患者情况综合应用,才能有助于不同病程阶段的心功能优化。心衰每个阶段治疗的目标和方法虽有重叠但又各有区别,明确疾病自然进程的整体认知、疾病谱、临床场景中患者流的位置非常重要。
(2)疾病谱变迁推动心血管器械30年演变,下个10年属于心衰的器械治疗

图1. 疾病谱变迁推动心血管器械30年演变
随着国内疾病谱的演变,中国心血管器械产业即将经历第3波重磅品种——心室辅助装置(VAD)带来的百亿赛道机遇。
①PCI:自我国改革开放以来,随着经济发展带来的百姓生活方式的改变,上世纪90年代以来,以冠心病、糖尿病为代表的慢病患病率快速增长,极大促进了相应的药物与器械治疗发展。我国冠心病介入自1983年引进,经1996-2005年普及发展,2000-2010年的手术成熟规范规模化,带给国产PCI产业了一波百亿机遇,助推了以微创、乐普为代表的上市公司,成功的完成了产业的国产替代。
②瓣膜介入:随着2010年前后建国首批“婴儿潮”-“50后”进入60岁关卡,我国人口结构进入老龄化社会。与老龄化相关的瓣膜病发病率快速增长,改变了瓣膜病过去的病因构成(风湿性瓣膜病为主),又因为老龄患者对于外科创伤难以耐受性,推动了介入瓣膜的国产化。以2018年港股18A政策解除了未盈利器械公司的IPO瓶颈,巨大的市场空间早就了一批以启明医疗、微创心通、沛嘉医疗为代表的TAVR上市公司。后续更大的二尖瓣、三尖瓣介入修复市场空间机遇,会推动后续更多的瓣膜上市公司。
③心室辅助装置(VAD):随着过去20年我国心血管慢病的病程演变,以高血压、冠心病为代表的心血管病将随着老龄化进入心血管病最后的战场——心力衰竭阶段,不断增长的发病率与患病率带来医疗负担。而心衰的发展过程必将进入药物无效的病程阶段,以VAD为代表的心衰治疗器械将得到极大发展。并且,随着过去10年我国制造业的积累与高等教育发展下的工程师红利,对于有“医疗器械皇冠上的明珠”之称的VAD有望国产化。在未来十年,在国家政策与国内资本市场创新与发展的大背景下,国产VAD有望在产业中规模性超越进口,并诞生多家上市公司。
(3)心衰的器械治疗需要全面的综合方案
心脏的正常功能,依赖于规律的心电节律使得心肌规律收缩、正常搏动泵血。当急性或慢性心衰发生时,心肌功能失调体现在三个方面:心脏结构(心肌与瓣膜)异常,电活动紊乱、心肌收缩能力减弱(心脏的机械活动)导致泵血失能。而心衰的器械治疗正式分别针对以上三方面,解决方案呈现了多样化组合特点,临床中的应用需要根据患者的疾病发展阶段、发病具体情况与合并症选择相应的器械。
从发病阶段而言,心衰早期重在患者管理与风险因素预防,器械手段更多用于远程监护与患者依从性管理。从电学与机械动能的器械类别角度,有着同样的短期过渡治疗与长期植入治疗的需求。心衰进展期由于慢性心衰频繁急性发作与再住院、心原性猝死的短期高风险,都有巨大的过渡治疗(短期VAD与WCD)的需求;同样,在心衰终末期也有着替代治疗(长期VAD)与长期治疗(ICD)的共同特点。(见图2 中的“心衰病程阶段”与“器械治疗方式”)。
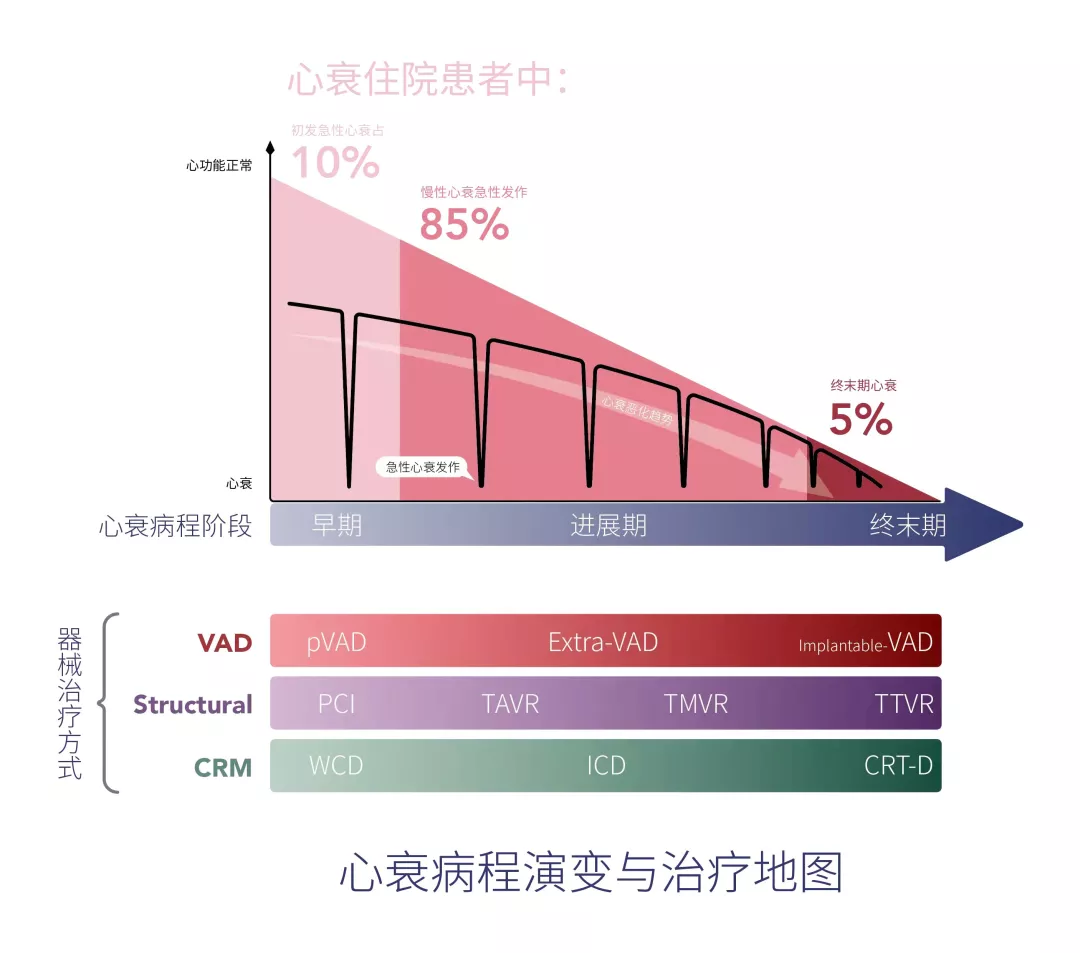
图2. 心衰病程演变与治疗地图
①结构学(心衰的结构改善):冠心病→缺血性心肌病→心衰的疾病谱演变催生结构心脏病产业迭代
由于心衰的一大部分患者为冠心病导致的缺血性心肌病,心室扩大后导致的有症状相对性二尖瓣返流(又称功能性二尖瓣返流,FMR),二尖瓣修复器械实际主要治疗的是心衰患者。近年来的经皮二尖瓣修复市场崛起,从另一角度显示了国内心衰患者的极大需求。而近年急诊STEMI介入的发展,也显示了我国急性心衰最大原发病治疗的巨大临床需求。
随着心衰病程的特点——从左心衰发展到合并右心衰,二尖瓣返流部分患者呈现二尖瓣+三尖瓣返流的进展阶段,由于外科三尖瓣修复手术的高死亡率推动了三尖瓣介入修复的市场发展。
同时,心衰的结构治疗不断发展,逐渐呈现出器械“非标品”的特点,市场中的解决方案可以看到各种结构构型的二尖瓣修复/置换器械,如缘对缘、人工腱索、瓣环成型、各式构型的瓣膜置换等,其他还有针对射血分数保留的心衰(HFpEF)的房间隔分流、造瘘等器械,针对左心室腔改构的限制性心包类器械、降落伞等,原理上都是降低左心室前负荷从而缓解或治疗心衰。一方面心衰结构治疗给创新器械尤其是concept层面极大的创新空间,另一方面,由于器械的多样化带来临床样本量的减少,循证医学的证据有待完善,目前只有雅培mitraclip在全球有规模化成熟的应用。
②节律管理(猝死预防):缺血性心肌病→心衰的猝死高发催生前期猝死预防需求
心衰是心脏性猝死相对常见的一个病因,30%-50%的心衰患者死亡由心脏性猝死所致,并且在心衰症状加重期间心脏性猝死的发生率有增加。
心衰进程与心脏性猝死发生率相关:随着心衰进展从初期(A、B期或NYHA II)进展到中、终末期(C、D期或NYHA III、IV期)猝死的发生率与概率越来越高。心衰患者的死亡原因中,进行性泵衰竭、意外心脏性猝死和心衰临床恶化发作期间发生的心脏性猝死分别约占心衰死亡总数的1/3。39%心衰患者的猝死被认为是由心律失常引起。
目前,猝死一级预防的时间窗在患者血运重建3个月以后评估考虑植入ICD,而3个月内患者依然是高风险期,左心室功能不全患者(如LVEF≤30%)在PCI或CABG术后早期的死亡率显著更高。对于3个月内短期高风险患者,可选择无创的WCD进行短期过渡性风险预防(3个月内),其后针对具有长期猝死高风险的患者可选择植入ICD。
③机械动能(循环辅助):急性心衰短期辅助与终末期心衰的长期辅助治疗需求
如心衰进程中的电学异常一样,心衰的机械动能角度的失能也呈现了进展期频发、终末期持续的特点。在慢性心衰的进展过程中,会有多次急性发作,且发作频次随着心衰进程而提高,最终演变为终末期心衰的持续性心功能不全。由于在急性心衰发作很大可能短期(1个月内)恢复,对于循环支持的需求时间窗一般仅需3个月内的短期循环支持,很少需要长期植入型VAD(创伤性的代价与价格综合考量),此临床场景更需要短期VAD的一线抢救或过渡性治疗,当患者恢复后撤机出院,可以不必长期植入。而终末期心衰患者需要长期循环支持,心脏移植或长期植入型VAD是更适合的选择(见图4)。
2. 心衰目标市场空间:急性与慢性心衰
(1)心衰细分需求的患者数量:急性心衰95%,终末期心衰<5%
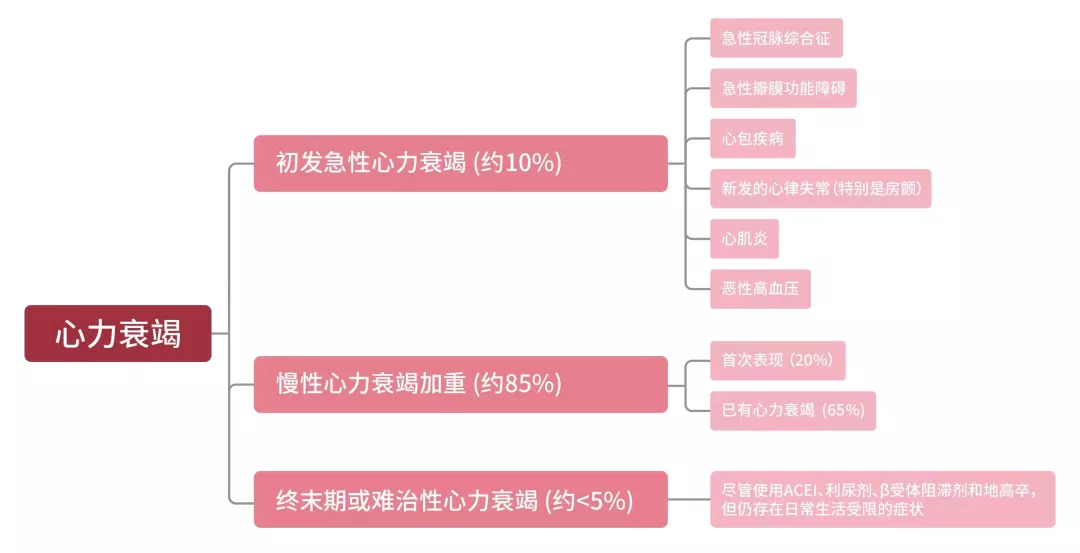
图3. 心衰各细分目标市场空间
住院心衰患者中,绝大部分为慢性心衰急性加重或初次急性发作的患者,这类患者占全部住院患者的95%(见图3)。在所有进院心衰患者中,包含三部分患者:
①各种原发病导致的初发急性心衰:包括急性冠脉综合征(以急性心梗为代表)、房颤导致的初发急性心衰,往往就诊于急诊,在我国往往在急诊的胸痛中心直接进行原发病治疗(急诊PCI)。近年来我国心衰的病因构成发生明显变化,瓣膜病(尤其是风湿性瓣膜病)所占比例逐年下降,而冠心病、高血压和扩张型心肌病已成为心衰主要病因。
②慢性心衰急性加重:心衰逐渐恶化的过程中,进展期心衰常有多次急性失代偿发作(见图2 “心衰恶化趋势”的曲线),每次发作可能有多个因素造成,这些患者常有心力衰竭的高危因素(例如高血压或缺血性心肌病)。住院心衰患者的65%有已知心力衰竭,但未达到终末期或难治性心力衰竭的状态[7, 8, 9]。
③终末期心衰:约占所有住院心衰患者的5%,患者处于常用ACEI、强心利尿等药物治疗无效状态,并存在日常生活受限的症状。
2019年国家医疗服务与质量安全报告(来自国家医疗质量管理与控制信息网NCLS和全国医院质量监测系统HQMS,共收集2016-2018年1861家三级医院与2151家二级医院的295,230,818例住院患者病案首页数据)显示,全国综合医院心力衰竭患者出院人次2,830,134人次(三级综合医院1272家抽样,总出院67,305,874人次)、832,548人次(二级综合医院1680家抽样,总出院26,441,935人次),平均住院日月8.96-9.64天,每住院人次费用7211.68-12092.71元。[10]我国2019年三级医院出院人次104,830,000人次、二级医院出院83,800,000人次,由此估计,2019年我国心衰总出院约7,046,498人次,我国住院患者中慢性心衰急性加重患者约599万人次,终末期心衰患者约35万人次。另外,急性初发性心衰的主要原因——急性心梗、高危PCI介入的数量更是超百万人次。
(2)心衰进程中最高发的临床场景——急性心衰
急性心力衰竭(acute heart failure, AHF)是指继发于心脏功能异常而迅速发生或恶化的症状和体征,既可以是急性起病(如急性心梗合并急性心衰),也可以表现为慢性心力衰竭急性失代偿(acute decompensated heart failure,ADHF),其中后者更为多见,约占70%-80%。由图2可见,多数慢性心衰患者在进展期,常因各种诱因(如心律失常、呼吸道感染等)急性加重而反复住院治疗——慢性心衰急性发作,多数经治疗后症状部分缓解而重新转入慢性心衰的进程。AHF是常见急症,常危及生命,对疑诊AHF的患者,必须快速诊断和紧急抢救治疗,在完善检查的同时即应开始药物和器械治疗(VAD)。
AHF有以下特点:
高死亡率高再住院率:AHF预后很差,住院病死率为3%,6个月的再住院率约50%,5年病死率高达60%。我国急性心衰住院患者在住院或出院后3天的死亡率为3.2%,出院后第4天至第一次随访期间的死亡率或再入院率为22.4%。在急性心衰入院后的30天内,2%的患者发生心源性猝死或心肺复苏或室性心动过速/心室纤颤[11]。
发作频次——心衰进程一旦开始住院,住院的频率会增加:一项研究对1987-2006年新诊断的慢性心衰患者的数据统计发现,5年随访期内1077例患者经历了4359次住院治疗。83%的患者至少住院一次,67%多次入院。而且,心衰住院次数越多,则再次住院治疗的概率以及后续住院概率大幅增加。无论什么原因住院治疗的患者1年内的再入院率是60%-69%。接受两次及以上住院治疗的心衰患者,1年内,有60%再次住院治疗,90%由于心血管疾病,60%是由心力衰竭导致[12, 13]。
严重程度——心衰每次住院的死亡率会增加:心衰患者住院治疗本身就是病情恶化的标志,从而增加了死亡率以及早期再住院的风险[11, 14, 15, 16],心衰住院患者的死亡率是未住院患者的5.22倍(P<0.001)[14]。加拿大医保数据库的分析显示,心衰入院患者中,每次再入院都会导致死亡率上升[16]。在慢性心衰门诊的患者,一旦病情恶化住院治疗,死亡率将显著增加。无论是收缩期或舒张期心衰患者,每次住院后心衰患者死亡率增加已是不争的事实。
AHF临床表现是以肺淤血、体循环淤血以及组织器官低灌注为特征的各种症状、体征,合并心原性休克。AHF治疗目标依据心力衰竭的不同阶段而不同,早期急诊抢救阶段以迅速稳定血流动力学状态、纠正低氧、改善症状、维护重要脏器灌注和功能、预防血栓栓塞为主要治疗目标;后续阶段应进一步明确心力衰竭的病因和诱因给予相应处理、控制症状和淤血,并优化血压,制定随访计划,改善远期预后。AHF治疗原则为减轻心脏前后负荷、改善心脏收缩与舒张功能、积极去除诱因以及治疗原发病变。
3. VAD临床需求区隔
VAD原理决定临床实际应用时需要从流量、时间与创伤的综合考量:人体正常心排出量为4L/min左右,常见的VAD由于原理的不同,流量分为半流量(2-3L/min)与全流量(>4L/min)辅助。当心衰发生时,心排出量骤然减低需要循环辅助,内科与外科不同患者流入口所能适配的VAD入路条件不同。常见的有三类场景:
(1)心衰患者上游:救急救命(介入式VAD,常用于急性心衰)
急性心衰的临床场景在临床中多见(见图4):①慢性心衰进程中,即使在慢性心衰早期,当合并呼吸道感染时也会导致急性心衰发作,②急性心梗等突发心血管疾病患者中,或,一些冠心病的特殊病变,如左主干、左前降支回旋支的近端重度狭窄等,可能在PCI术中(又称高危PCI)球扩时引起左心大面积缺血导致的心源性休克。③心外科术后低心排综合征。④等待心脏移植患者中,移植之前对整个心功能有相应的要求,需要体外VAD进行心功能调整。⑤各种原因的急症,如外伤,等原因导致的急性心功能不全。
患者心脏有一部分泵血功能,但不满足全身脏器灌注需求时,需要半流量短期(1周以内)支持即可满足患者循环辅助需求,常见于各种原因导致的急性心衰的抢救、急性心梗预防休克或休克抢救。由于一线抢救常见于内科、急诊科室,从操作简便性而言,股动脉穿刺的经皮路径是对于几乎所有临床科室门槛最低的操作,最适合应用的是介入式VAD(如impella)。需要提到的是,目前国内常用的IABP虽然能通过反搏增加冠脉及脑部血供,但是流量仅几十毫升,当休克发生时流量不足以维持脏器灌注。而急性心排量不足的情况下,如果不对各重要脏器进行第一时间的血液灌注维持,由于心-肾综合征会导致急性肾脏灌注不良从而导致急性肾功能损伤(AKI),从而直接影响患者的近期与远期转归。
从临床角度综合考虑,应第一时间快速进行循环干预,且干预时间越早患者转归越好。近年的临床指南趋势显示,短期VAD的干预时间点趋势逐渐向一线发展,从休克发生时→预防性高危PCI→STEMI一线预防的方向发展:JACC心衰治疗指南(2013),经皮或体外心室辅助装置可作为HFrEF患者出现急性、严重的血液动力学损伤时的短期机械循环辅助疗法(IIa);2011 年 ACCF/AHA/SCAI 经皮冠状动脉介入治疗指南、2015 年 SCAI/ACC/HFSA/STS 关于在心血管疾病管理中使用经皮机械循环支持的临床专家共识,推荐用于高危PCI患者的术中保护;2018 年 ESC/EACTS 心肌血运重建指南,推荐用于心功能不全的急性冠脉综合征患者。
由于介入式VAD的经皮的微创优势,带给介入式VAD最接近一线治疗的优势。同时由于技术层面的天然物理限制,介入式VAD难以做全流量长时间(7天以上)的循环支持。这是因为人体股动脉有直径的解剖上限,当血泵做的足够小到可以伸入人体股动脉时,需要把血泵泵头位置的叶轮尺寸做小(几毫米)。而如此小的叶轮为了保证2L以上的流量,通常转速达到每分钟2万转以上,必然引起相关溶血并发症。所以,介入式VAD的优势在于“救急”与“预防”,在临床急诊、内科病房或介入导管室内出现急性心衰、突发休克时,介入式VAD可以快速抢救,待患者循环稳定后进行下一步治疗。
介入式VAD采用轴流旋转式血泵技术,可经介入导管植入人体进行短期循环支持。目前市面上已有的介入式VAD只有Abiomed的Impella系列,包含已经过的FDA、CE批准用于临床左心辅助的2.5、CP、5.0、5.5、LD型号和右心辅助的RP型号,临床试验阶段的下一代产品ECP型号。两款介入式VAD(Impella 2.5 和 Impella CP)主要针对微创的高危PCI保护与心源性休克短期治疗市。Impella能够直接降低心室体积(前负荷),并且能够一定程度地增加循环血流量。临床试验显示,矫正患者病情严重度后,Impella相比IABP 可更有效地稳定血流动力学且和更高的生存率相关。
介入式VAD趋势:更小创伤性、更快的介入方式、更早的干预时机
自从2015-2016年impella在FDA获批高危PCI的适应症以来,在心内介入领域的渗透率与使用患者逐年高速增长。截止目前,所有PCI术中impella的渗透率达到19%,高危PCI中渗透率达到34%,美国医生调研显示,无论心内、心外科,医生均认为impella会在未来2-3年内持续高速增长,渗透率将达到总PCI手术量的27%。美国心内科医生高危PCI中使用impella的比例高达64%,其中单独使用impella达到57%,而传统手段IABP的使用比例已经萎缩至28%。
在行业发展趋势上,介入式VAD再不断的技术迭代——持续的器械小型化与血液相容性提高。临床试验中的Impella ECP是目前世界上最小的心室辅助装置,介入尺寸仅 9 F(3 mm),尺寸降低与更简便的输送系统,减少了血管并发症;ECP泵头在主动脉内可扩张到18 F直径,叶轮运转直径变大后流量可达到3.5 L/min以上,血液相容性明显提高。
同时,临床研究逐步以有力的循证医学依据推动了适应症扩展并将VAD干预时机提前,最近的两个重要研究是:①PROTECT IV:基于这个临床研究的证据,高危PCI的目标市场空间扩张>3倍。②STEMI-DTU RCT:正在进行的STEMI DTU研究, 是一项前瞻性、多中心、双臂随机对照试验,试验计划招募 668 名接受 STEMI(ST 段抬高型心肌梗死)治疗的患者,之前的预实验显示,Impella 在冠脉再灌注前使用可减少梗塞面积。有望在未来获批STEMI循环支持适应症后进一步扩展市场,占据约25%的STEMI患者市场。
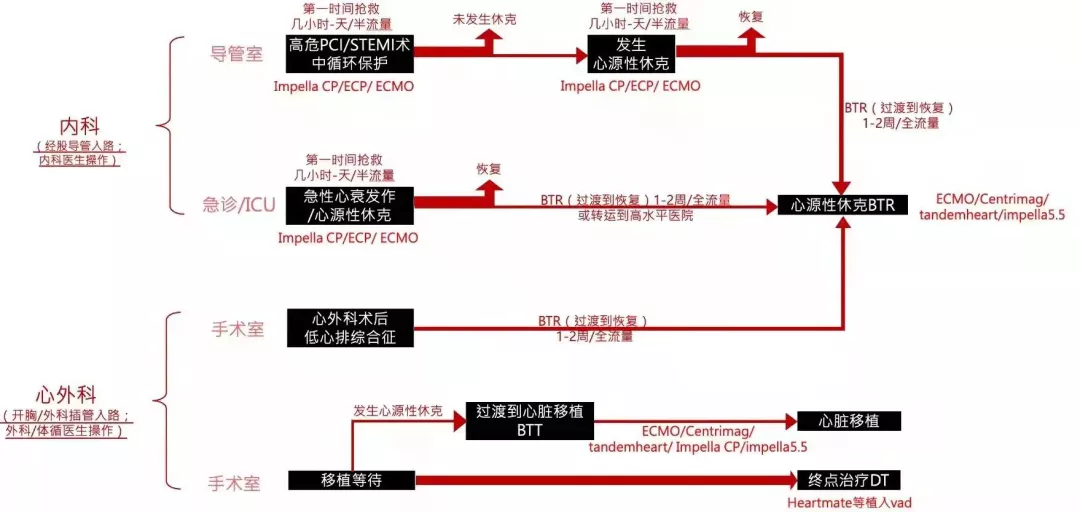
图4. VAD临床需求区隔与患者流
(2) 心衰患者中游:桥接过渡(中期/体外式VAD,常用于急性心衰进展)
当患者持续心排量不足需要较长时间(1周到1个月)心功能才能恢复,常需要桥接到全流量支持。常见的桥接治疗,包括过渡到康复(Bridge-to-Recovery, BTR)、过渡到临床决策(Bridge-to-Decision,BTD)、过渡到移植(Bridge-to-Transplant, BTT)。BTR常见于爆发性心肌炎、心外科术后低心排等情况;BTD常见于难以明确原因的急症,患者循环不稳定且短时间内难以恢复,需要稳定循环状态后给临床医生留出充足时间进行进一步诊断和治疗;BTT常见于心脏移植等待供心过程中患者心功能不佳的循环支持。
桥接过渡的患者特点是半流量循环支持不足以长时间维持机体灌注,且由于病情较重,全身对于流量要求高、对溶血等并发症敏感度高,所以患者必须长时间、全流量、高血液相容性循环灌注支持,保证各脏器机能正常。需要注意的是,桥接过渡也有时间敏感性,对于开始循环辅助的时机,对患者的预后也有极其重要的影响。心脏手术后患者出现休克,若从最初脱离体外循环到进行循环辅助过渡治疗之间的时间超过6个小时,则生存率就从44%降低到14%[5][17]。尽早使用循环辅助装置被认为能提高患者最终脱离辅助装置和出院率[4]。若建立循环辅助过晚,将导致疾病严重程度和器官功能不全的加重,生存率也将随之降低[1][5][18][19]。如果患者在开始短期循环辅助之前已发生心脏停搏,患者的生存率从47%降至7%[5][17]。
体外式VAD趋势:更高的血液相容性、更安全的桥接辅助
为了保证全流量支持,VAD需要扩大叶轮体积以增加泵血效率;同时为了长时间支持与高血液相容性,VAD需要降低血泵叶轮转速与优化流道,这就使得从机械原理上,负责桥接过渡治疗的中期VAD体积难以做到经皮VAD那样小,插管方式与ECMO相似。但是由于VAD可以进行左心室去负荷,在心衰患者的治疗上明显有利于患者心功能的恢复。与长期VAD(植入型VAD)相比,短期桥接的患者大部分都会康复或后续其他治疗,对于中间过渡环节,是否需要开胸植入的创伤代价及超高的自费价格,都是临床决策中综合考虑的重点。
目前市场上的体外人工心脏大多为离心式旋转血泵,为不断优化血泵中叶轮机械支撑点造成的血液损伤问题技术有过多次迭代,最新一代体外VAD为磁悬浮技术。磁悬浮血泵能在消除机械接触的基础上,保证转子和其它部件之间可以具有可控的、较大的血液流动间隙,减少叶轮转子在运动中对血细胞造成的伤害,提高长期血液相容性相关的长期循环支持安全性。以雅培的CentriMag为代表的体外VAD,可进行长达30天的各类中期循环支持,其他临床常见的中期支持VAD还包括ECMO, impella 5.0/5.5,tandemheart等。
(3) 下游:长期替代(长期/植入式VAD,常用于终末期心衰)
当慢性心衰进展到终末期等待心脏移植时,由于不适合心脏移植、供体不足或供体等待时间过长,可考虑植入长期VAD。心脏移植是终末期心衰有效治疗手段,但因供体匮乏催生最早期VAD的研发。近年来,临床研究数据显示长期VAD的临床效果接近心脏移植的长期生存率,对于终末期心衰的替代治疗,或终点治疗(destination thrapy, DT)逐渐成为长期VAD的主要适应症。
植入式VAD趋势:更长期的辅助支持、终点治疗
心脏移植是终末期心衰有效治疗手段,但因供体匮乏,全球每年实施心脏移植手术约5000余例,美国每年实施2000多例移植,我国心脏移植的供体来源更加困难,目前不到500例。VAD性能主要取决于血泵内的转子的支承方式,从早期的搏动泵,到二代机械接触轴承式(雅培的heartmate II)、流体动压轴承式(美敦力的HVAD),第三代为全磁悬浮式(雅培的heartmate 3)。
随着技术迭代,在患者远期生存率和生活质量上有了明显的提高。根据临床统计,目前Heartmate 3的患者3年内生存率已超过心脏移植,且前3年生存率高于心脏移植。由于三代全磁悬浮的技术路径,较之二代泵在血液相容性方面有明显提升,远期不良事件的发生率,尤其是血泵导致的血栓相关神经系统并发症(2021年美敦力HVAD因此召回)也呈现出下降趋势。2018年年市场的VAD植入数量中已大部分(80%)被heartmate3所占据,但由于长期植入的特性,植入类VAD的患者管理是关键,目前主要并发症——经皮电缆感染仍有待解决。
适应症之间的迭代方面, 长期植入(DT)逐步成为终末心衰治疗的主流。随着医疗管理、患者选择和技术的不断提高,VAD产品的适用范围从心脏移植的过渡(BTT)逐步演变为长期植入的替代性治疗,成为心衰患者的终极治疗手段,逐步为外科医生和心衰患者所接受。
来源:CCI心血管医生创新俱乐部












