法规政策
-
2023.09.25
FDA更新!2023有源医疗器械创新论坛分享生物相容性指南,明确不需要进行测试的器械和材料
教科书里,生物相容性是指生物医用材料与人体之间相互作用产生的各种生物、物理、化学反应的性质,包括组织相容性、血液相容性、力学相容性以及免疫相容性等方面,是生物材料研究中贯穿始终的主题。

阅读更多 -
2023.09.19
2023上海医疗设备展浅谈欧盟医疗器械法规(MDR)
医疗器械法规(EU)2017/745(以下简称:MDR)自2021年5月26日起正式生效,取代了迄今为止一直有效的93/42/EEC指令(以下简称:MDD)。MDR的主要目的是为医疗器械建立高质量的标准,协调有关医疗器械投放市场的规则,并对整个欧盟进行有效监督。毋庸置疑,历经过去20年的行业发展与进步,立法的改变是迫切需要的。
阅读更多 -
2023.09.14
2023上海医疗器械创新展全面解析医疗器械进口美国的FDA认证要求
医疗器械FDA认证对于产品进口到美国的要求是非常严格的。作为美国食品药品监督管理局(FDA)对医疗器械质量和安全性的认可,FDA认证是医疗器械在美国市场合法进口和销售的重要条件。

阅读更多 -
2023.09.07
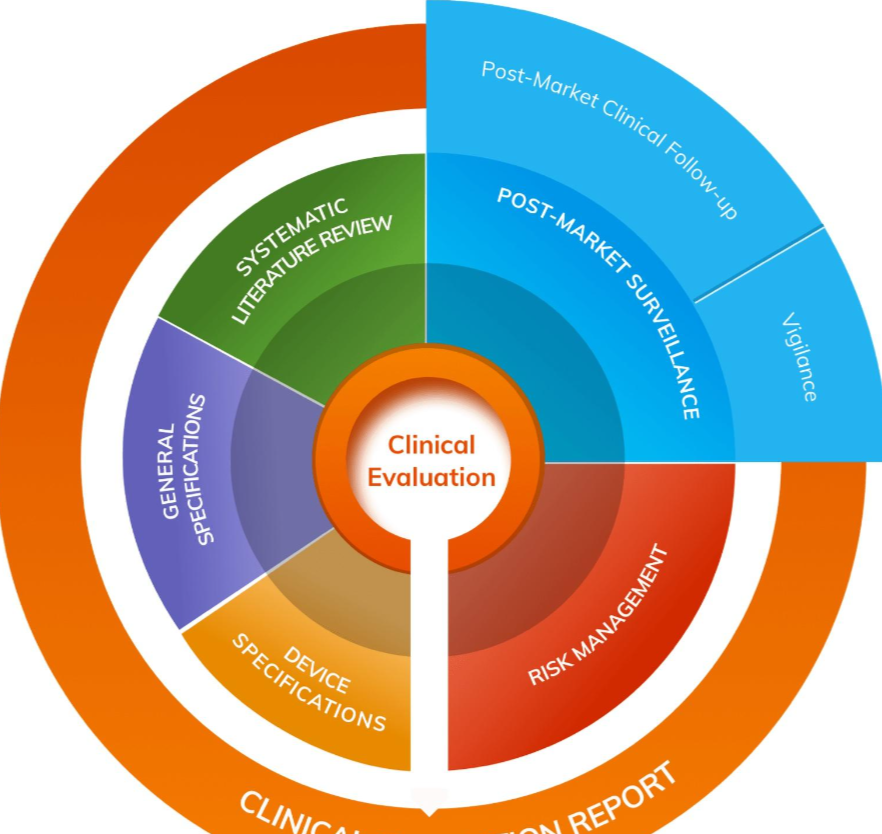
2023医疗器械展会解析临床评估报告CER:规避医疗器械法规中的常见陷阱
临床评估报告(CER)是MDR中的一份重要的技术文件。有效的临床评估报告描述了对所有可用临床证据的结构化评估和分析,以此评估医疗器械的安全性和性能。虽然临床评估是一个持续的过程,但临床评估报告按照设备的风险分类间隔提供临床评估结论的阶段性结论。
阅读更多 -
医疗器械GMP“设计变更控制”,上海医疗器械展会解答分类的难点问题
在药品生产过程中,发生变化是非常正常的。即使在R&D能力相对较高的发达国家,每年控制一个品种在5-10个之间的变化也是很常见的,如果涉及到新产品、无菌产品、生物制品等。数量会更多。而在国内,目前对变化的控制还达不到国外的先进水平。如果控制执行不力,药品质量安全的风险系数会大大增加。近年来,国内医药行业爆发的“药害”事件,很多都是因为生产中的变更控制不力!

阅读更多 -
2023.09.06
9月起实施!2023上海医疗设备展速递人工智能等医疗器械行业新标准
人工智能技术已经成为医疗器械领域的热门话题,它的应用领域包括医学图像处理、诊断、治疗和疾病管理等。人工智能技术已经被广泛应用于各种医疗器械设备中,例如CT扫描、MRI、X光机、超声波等。

阅读更多 -
2023.08.31
医疗器械展解读上海市药品监督管理局印发的《上海市医疗器械注册质量管理体系核查减免现场核查指南(试行)》
近日,上海市药品监管局印发《上海市医疗器械注册质量管理体系核查减免现场核查指南(试行)》,进一步优化本市医疗器械注册质量管理体系核查机制,持续提升医疗器械审评审批效率,推动医疗器械研发成果转化和产品上市,更好满足公众用械需求。

阅读更多 -
2023.08.28
医疗器械展密切关注:二类无源医疗器械注册申报
医疗器械注册申报是一项较为繁琐的工作,注册过程中我们总会遇到各种问题,本文密切关注一系列有关第二类无源医疗器械首次注册申报时的问题,相关企业别忘收藏备用哦!
阅读更多 -
2023.08.25
2023医疗器械展览会解读上海市器审中心发布的《第二类医疗器械独立软件技术审评指南》
为进一步指导和规范第二类医疗器械自研独立软件注册审评的过程,上海器审中心组织制定了《第二类医疗器械独立软件技术审评指南》,并于8月24日通过其官方微信公众号发布。

阅读更多 -
2023.08.17
高端医疗设备展解读广东省药品监督管理局医疗器械注册人、备案人延伸检查管理规定
医疗器械管理规定指的是在医疗器械的生产、销售、使用等环节中,为了保障人民群众的生命健康.而出台的一系列管理制度和规章。

阅读更多












