质量管理
-
2023.12.14
Medtec中国展罗列医疗器械中的不良事件术语
IMDRF之前出了一份关于不良事件术语的文件 IMDRF/AE WG/N43 以及对应的附录A,B,C,D,E,F,G. 本文分享Annex A: Medical Device Problem 附录A: 医疗器械的问题。

阅读更多 -
2023.12.11
国际医疗器械展览会深度探讨设计评审:评什么,怎么评?
设计评审,就是对产品的设计方案进行评审,以便尽早发现设计错误或缺陷,进而对设计进行优化,提高设计的质量和稳健性。
设计评审,是产品评审的一部分,它为产品评审提供意见和建议。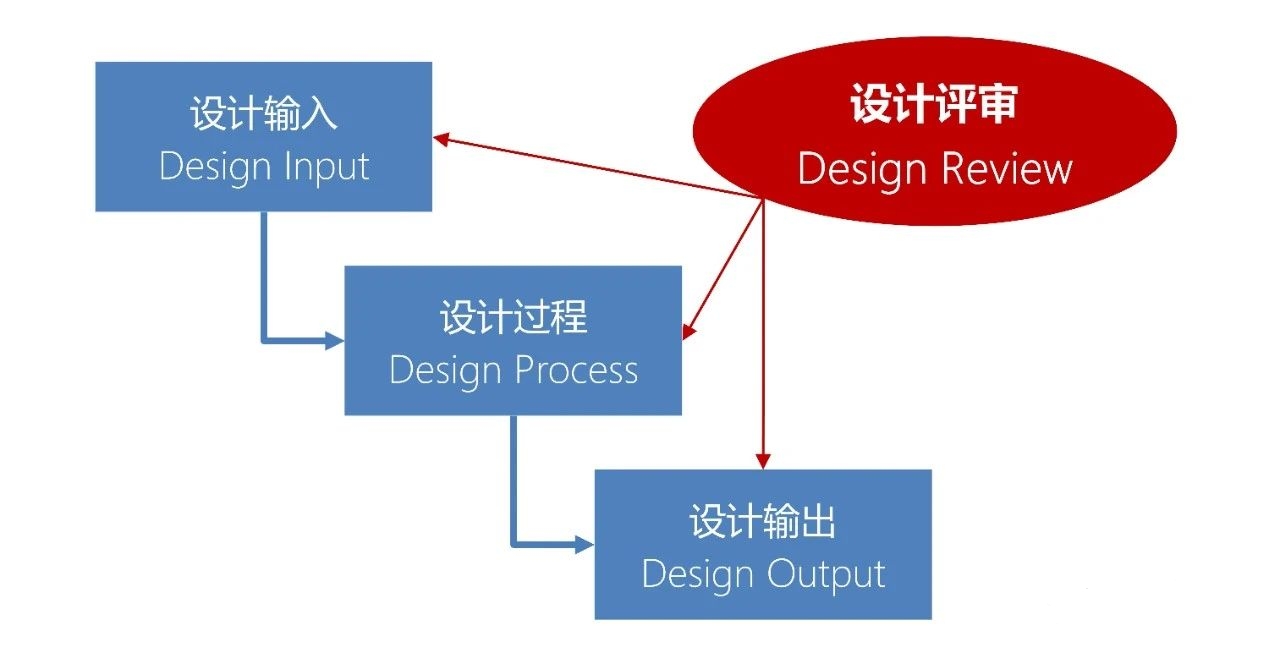
阅读更多 -
2023.12.01
深度解析:2023有源医疗器械创新论坛揭秘医疗器械可用性测试通用技术规范
可用性一般指在预期使用环境中,能够顺畅使用,从而具有有效性、效率、用户易学和用户满意的用户接口特性。本文具体介绍医疗器械可用性测试通用技术规范。
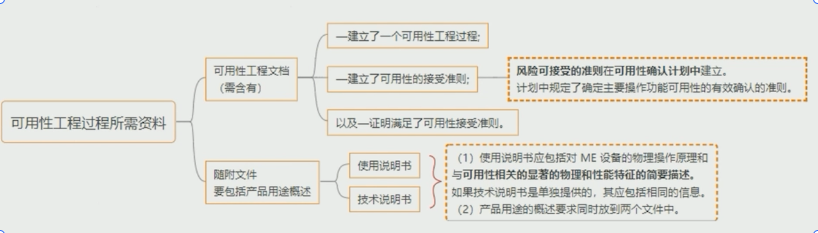
阅读更多 -
2023.11.28
Medtec中国展分析医疗器械的网络安全—漏洞评估,漏洞管理和协调漏洞披露的区别
在不断发展的网络安全领域,了解关键术语和方法对进入该领域的人员至关重要。漏洞评估vulnerability assessment、漏洞管理vulnerability management和协调漏洞披露coordinated vulnerability disclosure这三个术语经常交替使用,但含义却截然不同。

阅读更多 -
2023.11.23
上海医疗器械博览会浅谈产品设计中的可靠性(Reliability)

阅读更多 -
2023.11.22
Medtec中国展浅谈医疗器械生物学评价操作SOP
在医疗器械设计开发的过程中,生物学评价是至关重要且具有重要意义的阶段,也是不可或缺的里程碑事件。本文旨在通过学习实践,总结和思考生物学评价的实践过程、相关法规标准的要求、医疗器械生物学评价和审查指南、医疗器械原材料变化的生物学评价、无源植介入类医疗器械技术审评中的生物学关注点、医疗器械生物学评价路径选择、技术评审中的关注点、医疗器械生物相容性评价、医疗器械设计开发流程以及质量体系核查要求等方面,形成了本文关于无源医疗器械生物学评价操作的SOP。

阅读更多 -
2023.10.18
2023上海医疗器械创新展带您重新认识《创新医疗器械特别审查程序》
创新医疗器械特别审查程序(Special Review Procedure for Innovative Medical Devices)是中国国家药品监督管理局(NMPA)为了加快推动医疗器械创新和上市进程而设立的一项审查程序。
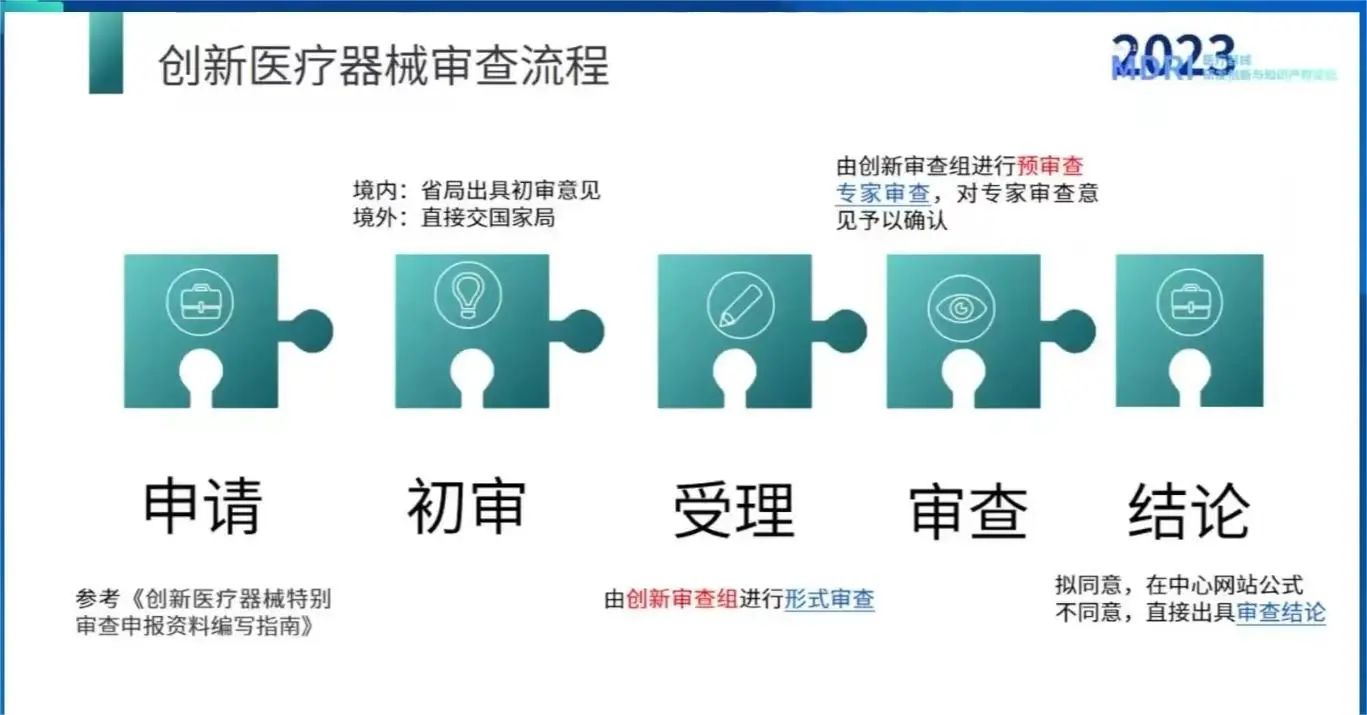
阅读更多 -
2023.10.10
医疗器械行业展览检测课堂:医疗器械注册检验样品是否需同一批次样品?
近年来一直关注医疗器械检测行业,了解到医疗器械注册检验项目:样品是否必须同一生产批次?问题的核心是关乎医疗器械注册检验样品的代表性。简言之,样品应当能够真实反映拟注册产品的性能和特点,而生产批次的同异并非硬性规定。

阅读更多 -
2023.09.12
2023上海医疗器械创新展政策法规演变之FDA伴随诊断监管
从FDA监管CDx的基本原则、CDx监管政策的演变历程、美国LDT和CDx监管的现状与未来三个方面进行了分享,将陆续分三期内容进行介绍。首先简单为大家介绍FDA监管医疗器械的法学基础。

阅读更多 -
2023.09.07
医疗器械制造展详解血管介入导管&导丝润滑涂层评价方式
血管介入诊疗的常用器材 周围血管疾病介入治疗的常用器材应包括:导管、导丝、球囊扩张导管、血管内支架和内支架移植物、滤器以及各种穿刺器械等几大类。近年来与血管介入产品涂层相关的并发症逐渐引起关注,聚合物润滑涂层的使用可能会由于涂层与基底的粘着力不良使其从器械分离或脱落,导致不良事件发生,并且可能对患者转归产生重大影响。
阅读更多












